

应用于外周神经系统的生物电子器件为转化医学提供了广阔前景,可治疗多种疾病,包括慢性偏头痛、中风、癫痫、抑郁症、步态障碍、膀胱过度活动症和高血压等。这些通过外周神经刺激的临床治疗,常是耐药患者化学疗法之外的唯一选择,且技术仍在不断发展。
然而,生物电子界面与外周神经长期可靠性和整合的关键挑战在于异物反应(FBR),这是生物电子器件在体内失效的主要原因。先天免疫细胞最初浸润界面,引发炎症反应,导致富含细胞的异物反应,包括巨噬细胞和多核巨细胞的形成。随着时间推移,成纤维细胞活化导致植入生物电子器件与外周神经界面处沉积富含胶原蛋白的纤维囊。慢性异物反应使这些纤维囊增厚,显著降低记录和刺激过程中的界面电性能,最终影响生物电子器件的使用寿命。
为应对异物反应带来的挑战,已出现多种材料设计策略,包括超软、亲水、润滑、药物缓释、两性离子、生物分子共轭和机械驱动等特性。尽管这些努力旨在减轻纤维化,但由于异物反应的发生在很大程度上与材料无关,以往的尝试均未能成功完全阻止纤维化的发生。因此,开发一种能有效抑制纤维化、实现长期稳定神经调节的生物电子界面具有重要的临床意义。
研究提出,生物电子器件与外周神经界面之间的强粘附性可完全防止纤维囊的形成。生物粘附水凝胶通过与外周神经表面形成共价键,实现生物电子界面的共形接触,从而抑制免疫细胞浸润界面和后续纤维囊的形成。这种粘附性有助于外周神经的电刺激或记录,同时防止界面微动引起的机械驱动型异物反应。
基于此,研究开发了一种粘附性非纤维化生物电子器件(ANB),旨在实现多样化神经上的可靠长期植入,且界面无纤维囊形成。该器件可包裹并粘附于体内不同部位、不同尺寸的外周神经,同时具备柔软、灵活、可拉伸、粘附性和导电性等关键材料特性,以适应生理环境中外周神经的长期稳定通信需求。
ANB采用生物相容性材料设计,用于基于粘附的多种外周神经植入,主要包括三层结构:
由于大鼠外周神经尺寸较小(直径300至1200μm),研究采用多材料三维(3D)打印技术精确图案化绝缘层和导电水凝胶,可在10分钟内快速、方便且精确地制造出分辨率为100μm的生物电子器件。
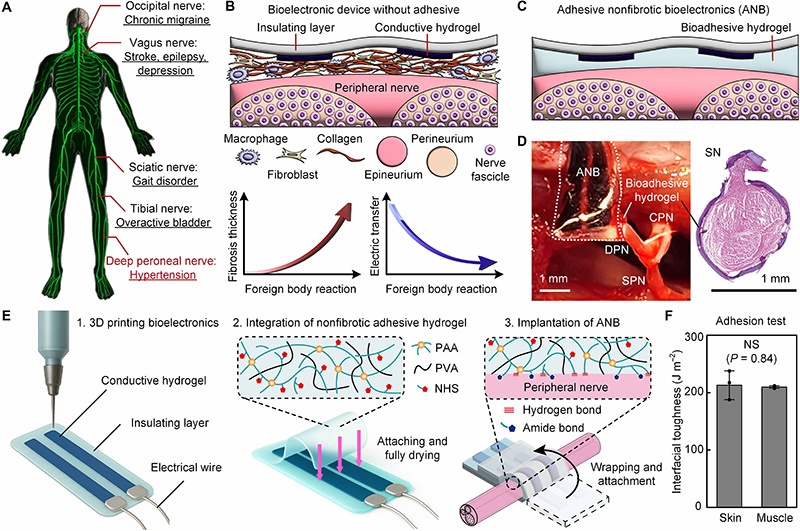
生物粘附水凝胶膜通过先前建立的方案单独制备,预拉伸以匹配其溶胀率,并在交联后立即附着到3D打印的生物电子器件上,然后干燥。与外周神经接触时,干燥的生物粘附层吸收界面水分,形成氢键(物理交联)和酰胺键(共价交联)。这种基于N-羟基琥珀酰亚胺(NHS)-胺共价偶联的粘附机制已通过实验验证。
ANB表现出有利于长期植入的机械性能:
与外周神经直接接触的生物粘附水凝胶层的杨氏模量(约0.1 MPa)与大鼠神经外膜(约0.4±0.1 MPa)相当,确保了与宿主组织的机械相容性。在20%应变下经过10,000次拉伸循环后,器件保持完整,各层之间无分层迹象,其高顺应性和可拉伸性适应了外周神经随身体运动的自然活动,从而提高了其在体内的长期稳定性。
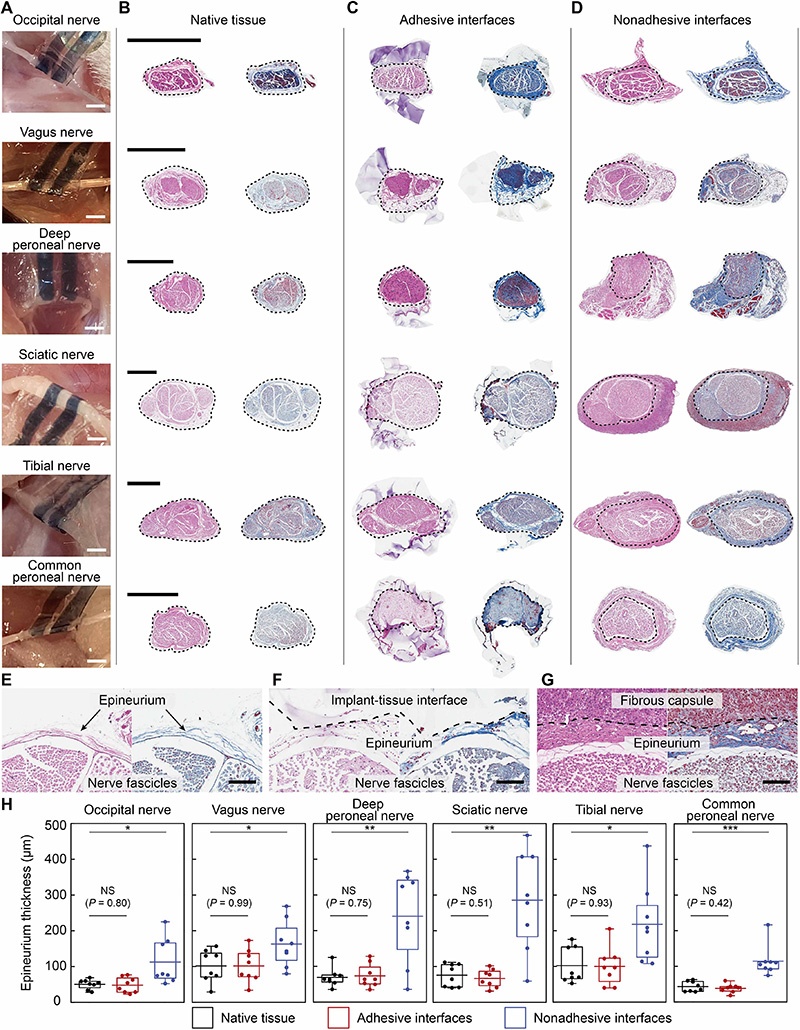
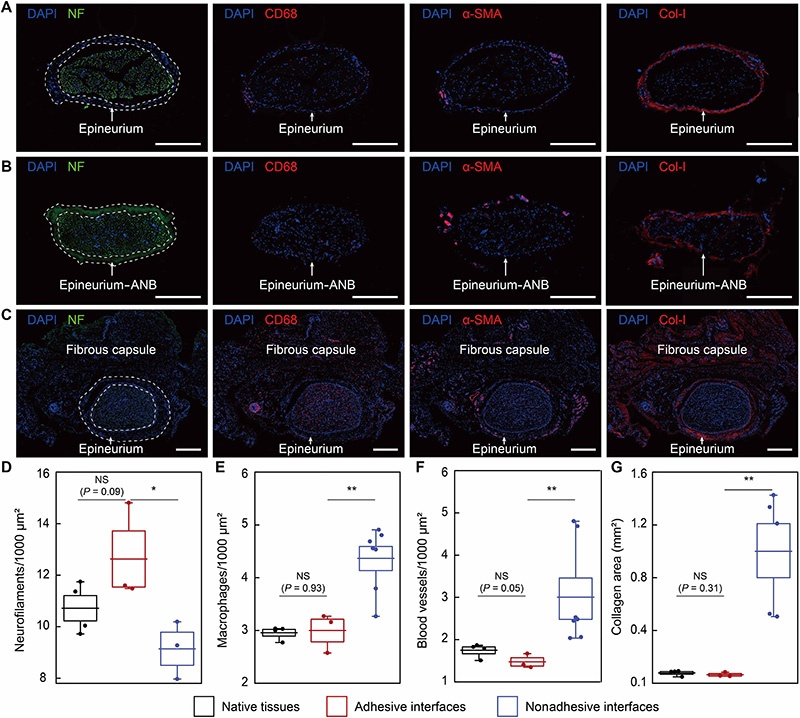
为验证ANB植入后4周粘附性生物电子界面是否保持非纤维化,研究通过苏木精-伊红(H&E)和马松三色(MT)染色的组织学分析,在Sprague Dawley(SD)大鼠模型中检查了外周神经表面的纤维囊,比较了三组样本:(i) 无植入物的天然组织;(ii) 附着ANB 4周的粘附界面;(iii) 非粘附界面(ANB先在无菌磷酸盐缓冲盐水(PBS)中完全溶胀以去除水凝胶的粘附特性,然后缝合在神经上)。
研究考虑了大鼠全身不同尺寸(直径300至1200μm)的外周神经,包括枕神经、迷走神经、腓深神经、坐骨神经、胫神经和腓总神经。组织学分析显示,天然组织的神经外膜周围表面完整,粘附界面未观察到可见的纤维囊形成,与所有考虑的神经的天然组织组相当;而所有非粘附界面在神经外膜外侧均表现出厚且富含细胞的纤维囊,包括脂肪组织坏死和随后的疤痕组织形成。
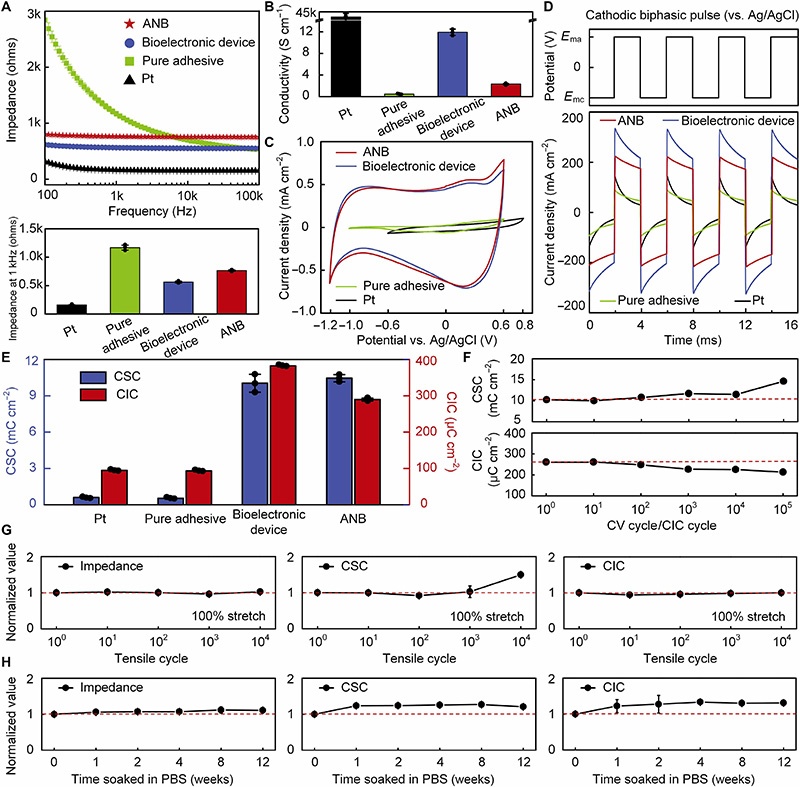
ANB的电性能表现优异,在1kHz时阻抗约为0.76千欧,导电率良好,电荷存储容量(CSC)约为10.5 mC/cm²,电荷注入容量(CIC)约为290 μC/cm²。与铂电极、纯粘附剂和仅3D打印的生物电子器件(无生物粘附水凝胶)相比,尽管应用生物粘附水凝胶略微降低了整体性能,但ANB仍表现出高质量的刺激电性能,这是因为水凝胶提供了足够的导电性,使电荷能够从电极转移到神经,同时阴极和阳极之间的相对较大间距防止了串扰。
在循环电测试、机械测试和室温PBS浸泡下的分析表明,ANB具有长期稳定性:在100,000次充放电循环中,CSC增加了43%;在100,000次CIC循环中,CIC下降了18%,但仍足以在体内刺激神经;在10,000次拉伸循环(100%拉伸)和室温PBS浸泡12周后,ANB的CSC和CIC保持稳定或有所改善。
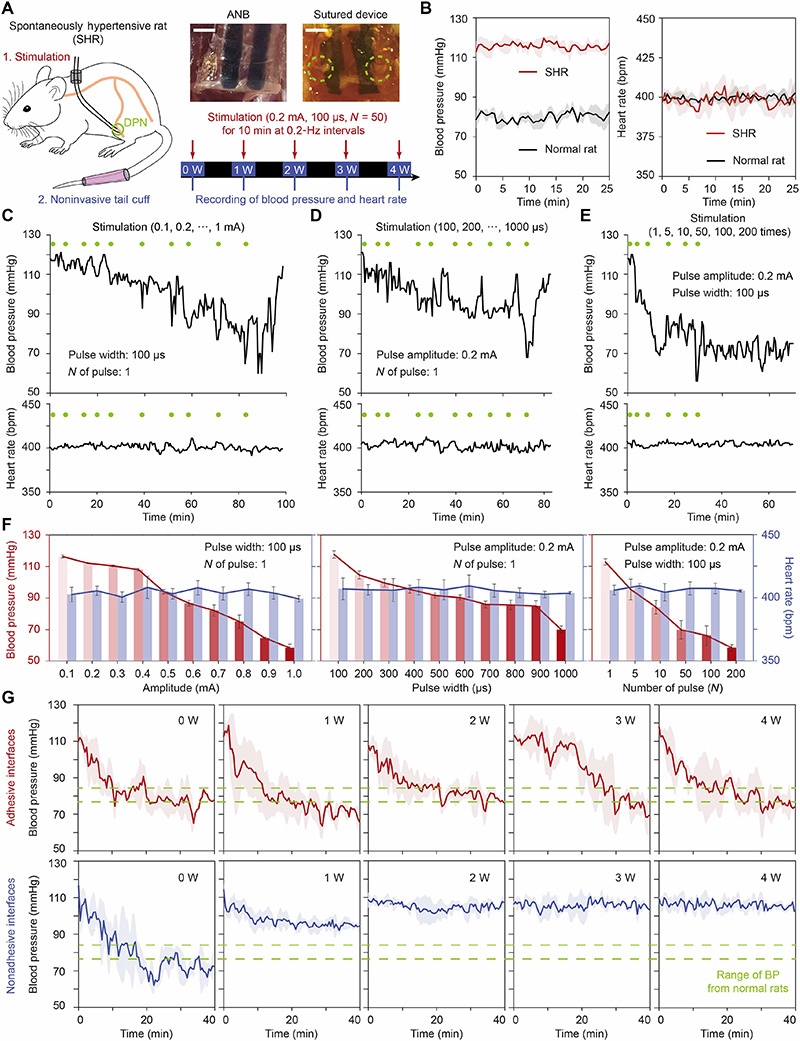
为评估生物电子器件中非纤维化界面的功效和重要性,研究使用ANB或非粘附器件刺激腓深神经(DPN)4周,通过无创尾袖法每周监测自发性高血压大鼠的血压(BP)和心率(HR)。选择血压调控作为主要功能读数,因为它是DPN传导的灵敏整体测量指标,即使是轻微的传导缺陷也会削弱这种全身反应,使血压成为比局部神经电图记录更具转化相关性的指标。
研究通过改变电流脉冲的幅度(0.1至1.0 mA)、宽度(100至1000 μs)和数量(N=1至200个脉冲),确定了最佳刺激参数:0.2 mA、100 μs和N=50个脉冲。使用该参数刺激时,自发性高血压大鼠的血压可降至正常大鼠水平,并在刺激结束后维持40分钟以上,且心率保持在约400次/分钟,未出现传统方法中常见的心率下降副作用。
长期刺激实验表明,ANB在4周的刺激后仍能实现血压调控,达到与正常大鼠相似的水平,各时间点血压下降幅度稳定在33%-37%;而非粘附器件仅在植入后立即能够调控血压,1周后刺激效果显著下降,4周时血压下降幅度仅为2%。
为进一步验证粘附性生物电子界面的长期抗纤维化性能,研究对每周刺激一次、植入12周后收集的DPN样本进行了免疫荧光分析,比较了天然组织、ANB和非粘附器件三组样本。结果显示:
| 项目 | 详情 |
|---|---|
| 论文标题 | Adhesive nonfibrotic bioelectronic interfaces on diverse peripheral nerves for long-term functional neuromodulation(多样化外周神经上的粘附性非纤维化生物电子界面用于长期功能神经调节) |
| 发表期刊 | Science Advances |
| 发表日期 | 2025年11月5日 |
| 论文DOI | 10.1126/sciadv.adz3668 |
| 作者团队 | Hyunmin Moon, Bastien F. G. Aymon, Jue Deng, Tao Zhou, Vincent Prevosto, Fan Wang, Jingjing Wu*, Xuanhe Zhao* |
| 研究机构 | 麻省理工学院、宾夕法尼亚州立大学 |
| 通讯作者 | Jingjing Wu(wujj@mit.edu)、Xuanhe Zhao(zhaox@mit.edu) |
|
|
全面解析森工DIW墨水直写3D打印机在该类研究中功能匹配情况及需定制功能,帮助用户更好地选择合适的3D打印设备及功能模块。
四喷头打印:配备精密的调压模块,调压精度±1KP,可将电水凝胶、绝缘层、生物水凝胶通过设备各通道实现各材料方案单独打印制备,以及生物电子器件打印;
①高温平台:恒温加热,便于将交联后附着到3D打印的生物电子器件上的水凝胶进行干燥,提高实验效率;
②为了提高实验效率,可使用独立二级平台,在生物粘附水凝胶膜实现单独制备交联之后立即进行生物电子器件进行附着,减少实验周期。
①高温平台:模块化设计,区域尺寸:200*150*60mm;控温范围:室温-100℃。
③独立二级运动平台:
a. 独立的运动控制系统,支持独立运动,模块化快拆快装,拆卸后不影响原来行程;
b. XYZ轴定位精度≤0.01mm;
c. 二级平台尺寸:257x290x69.5mm;
d. 二级平台可打印范围:200x150x30mm;
e. 二级平台独立移动范围:X≥100mm;Y≥160mm;Z轴≥6.5mm;便于打印过程中,通过显微镜实时查看每层的微观变化及中途干预。
由于小编学识所限,文中内容难免存在疏漏或不足之处。若您发现任何错误或值得商榷的观点,恳请不吝指正,
小编将第一时间修正完善。感谢您的包容与支持!
本文内容来源于网络公开素材,发布的目的在于学术交流、研讨分享,
如相关内容涉及侵权,请联系我们,将第一时间下架内容!


3D打印高性能Ag/BaTiO₃陶瓷-聚合物压电传感器,赋能生物医学应用
用于3D打印分层多孔电极的Co₃O₄/CeO₂高性能墨水,助力固态超级电容器能量密度跃升
基于直写式垂直 3D 打印技术、嵌入多个人工机械感受器的防水纤毛电子皮肤及其在船员健康管理中的应用

再传喜报,森工AutoBio1000直写3D打印设备助力华师大&韩国KAIST科研团队在材料科学顶刊发表高水平论文

关于不法分子冒用“森工科技”实施APP诈骗的严正声明
Structural-engineered V₂O₅/MoO₃ nanocomposite scaffolds via direct ink writing 3D printing for asymm