

大面积颅骨缺损修复是临床长期面临的难题,目前常用解决方案包括自体血管化骨移植、聚醚醚酮(PEEK)颅骨植入物及钛/钛合金网,但这些方法存在显著局限性:
研究团队前期开发的聚己内酯静电纺纳米纤维支架(3D定向拓扑结构)虽实现高效细胞募集与快速骨再生,但3D打印支架普遍存在细胞接种效率低、无法诱导细胞迁移的问题。因此,亟需开发兼具高效细胞募集、血管化促进及骨分化调控能力的新型骨修复支架,以解决大面积颅骨缺损的再生难题。
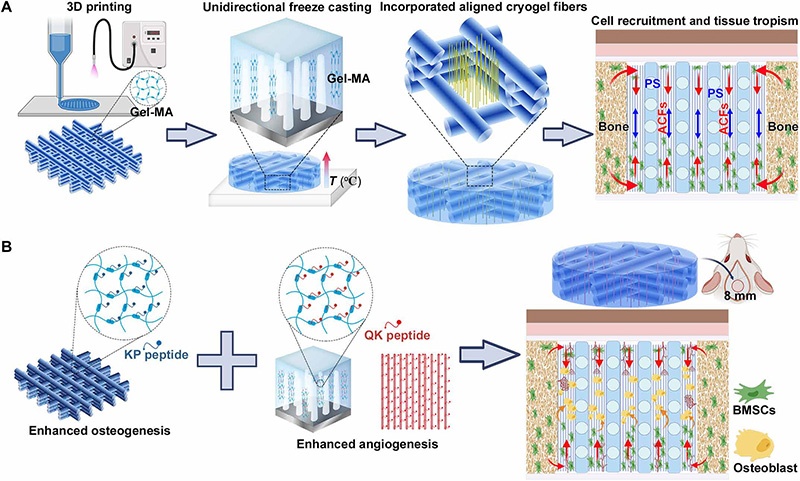
A:ACFs复合3D打印支架(PS/ACFs)的制造流程:通过3D打印结合定向冷冻铸造技术将ACFs嵌入3D打印支架,实现细胞募集与组织趋向性(红色箭头示细胞募集,橙色箭头示ACFs在颅骨缺损中的作用);
B:KP肽(骨形态发生蛋白2模拟肽)与QK肽(血管内皮生长因子模拟肽)功能化的PS/ACFs支架促进大鼠临界尺寸颅骨缺损修复的机制(蓝色箭头示新生胶原纤维方向,绿色箭头示骨髓间充质干细胞(BMSCs)的成骨分化);
注:Gel-MA为甲基丙烯酰化明胶,PS为3D打印支架,BMSC为骨髓间充质干细胞。
研究提出“结构引导-功能调控”双策略,设计并制备含垂直定向冷冻凝胶纤维(ACFs)且经QK肽(促血管)与KP肽(促成骨)修饰的复合3D打印支架(PS-KP500/ACFs-QK500),制造流程如下:
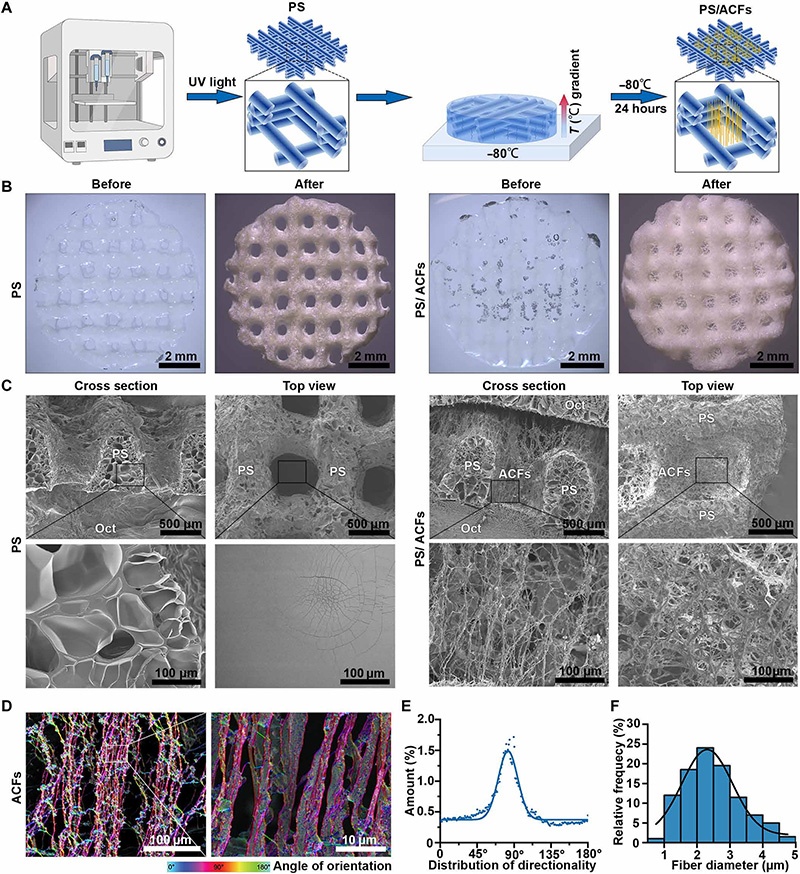
A:通过3D打印结合冷冻铸造制备ACFs复合3D打印支架的流程示意图(UV为紫外光);
B:PS与PS/ACFs冻干前后的宏观外观(冻干后PS/ACFs孔洞内填充白色纤维);
C:PS与PS/ACFs的扫描电镜(SEM)图(俯视图与横截面),可见PS/ACFs孔洞内充满垂直定向纤维,PS无纤维填充;
D:ACFs的伪彩色图(示纤维取向角度分布);
E:ACFs的取向角度分布(中位角度近90°,呈高度垂直定向);
F:ACFs的直径分布(1-5μm,均值2.46±0.86μm);
注:Oct为最佳切割温度化合物。
(1)理化性能:
(2)细胞募集能力:
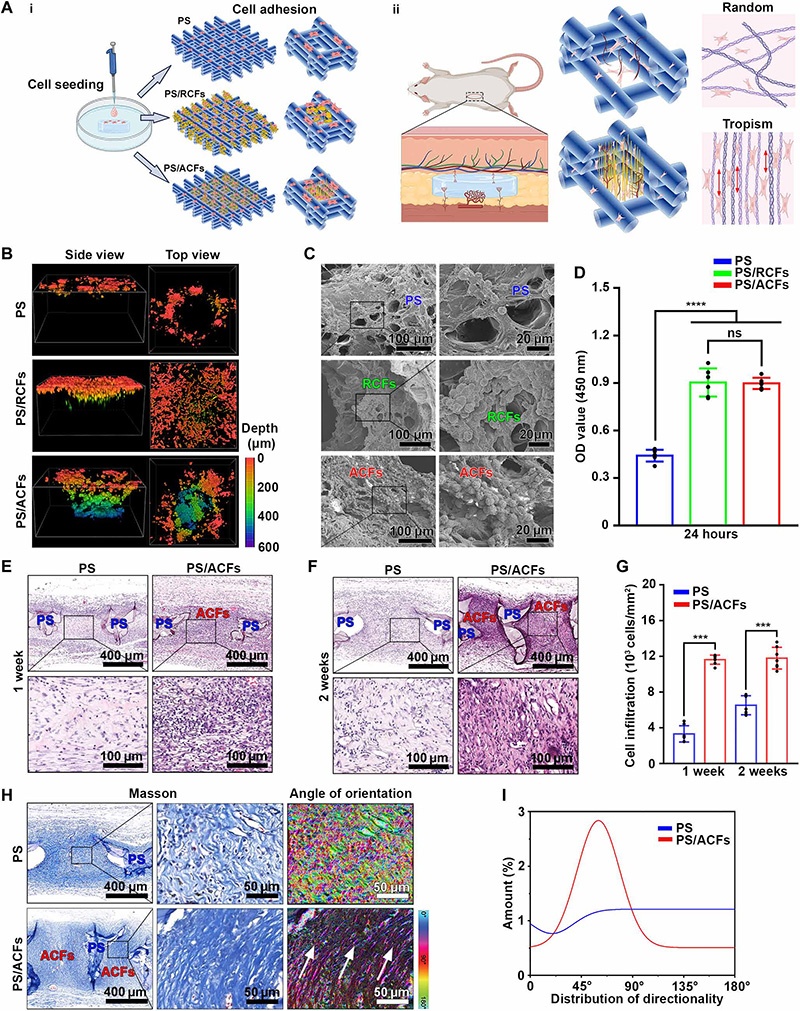
A:(i)PS、PS/RCFs、PS/ACFs的体外细胞接种与黏附示意图;(ii)大鼠皮下植入模型评估PS/ACFs的体内细胞募集与组织长入示意图;
B-C:共聚焦显微镜3D图像与SEM图(人脐静脉内皮细胞(HUVECs)接种24小时后):PS仅表面黏附细胞(深度<200μm),PS/RCFs细胞迁移至300μm深度,PS/ACFs细胞迁移至600μm深度,且细胞优先附着于纤维区域;
D:CCK-8检测(24小时):PS/ACFs与PS/RCFs的细胞黏附量为PS的2倍;
E-G:苏木精-伊红(H&E)染色与半定量分析(皮下植入1、2周):PS/ACFs的Gel-MA晶格间隙内浸润细胞更多,ACFs区域新生组织密度显著高于PS的空白区域,且无纤维囊形成;
H-I:三色染色(2周):PS组新生细胞外基质(ECM)纤维随机排列,PS/ACFs组呈有序排列(与ACFs方向一致),伪彩色图与角度定量验证PS/ACFs组胶原纤维取向一致性更高;
注:*P<0.001,****P<0.0001,ns为无显著性差异。
关键结论:ACFs通过定向拓扑结构引导细胞深度迁移(达600μm),显著提升细胞接种效率与体内组织长入,且诱导新生ECM纤维定向排列,为骨再生提供结构基础。
(1)KP肽修饰支架(PS-KP)的促成骨性能:
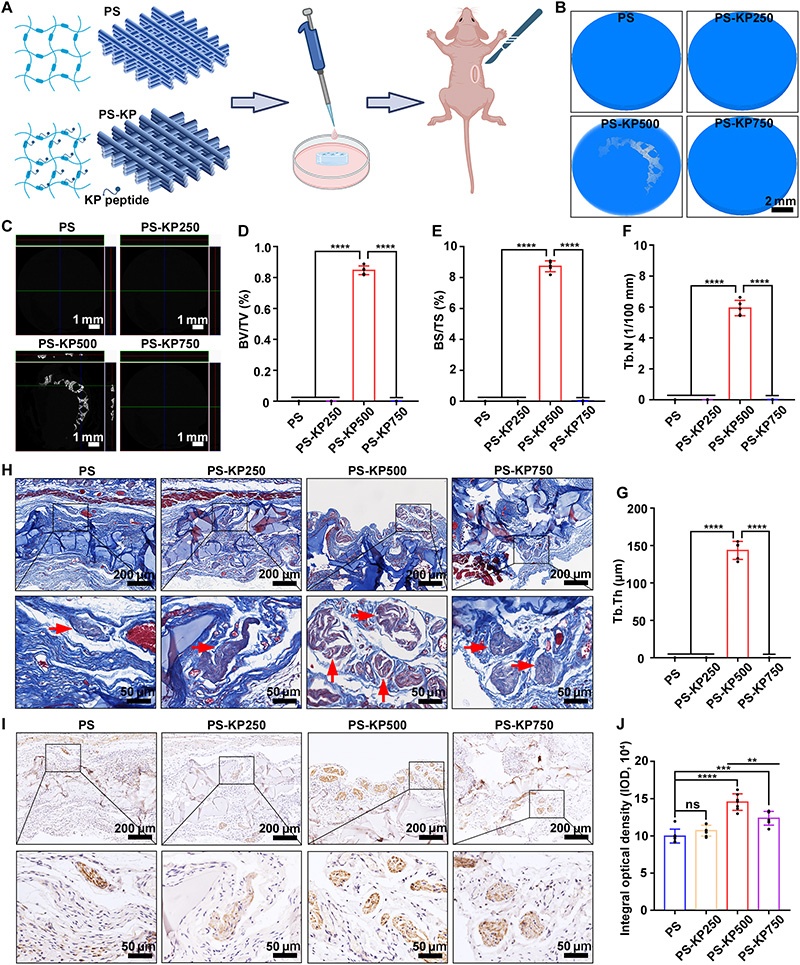
A:PS-KP的制备流程与裸鼠皮下异位成骨模型验证示意图(n=5);
B:Micro-CT 3D重建图(4周):PS-KP500组(500μg/ml KP肽)可见明显新生骨,PS、PS-KP250(250μg/ml)、PS-KP750(750μg/ml)组几乎无新生骨;
C:Micro-CT轴位、矢状位与冠状位图像:PS-KP500组新生骨呈与支架一致的晶格形态;
D-G:定量分析(4周):PS-KP500组的骨体积分数(BV/TV)、骨表面积分数(BS/TS)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)显著高于其他组;
H:三色染色(4周):PS-KP500组类骨质基质呈团块状分布,其他组仅少量或无类骨质;
I-J:骨桥蛋白(OPN)免疫组化染色与半定量:PS-KP500组OPN表达最高,显著高于PS-KP750组;
注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,IOD为积分光密度。
体外实验显示:PS-KP各组的大鼠BMSC(rBMSC)碱性磷酸酶(ALP)活性、ALP/OPN/骨钙素(OCN)基因表达均高于纯PS;体内异位成骨实验证实500μg/ml为KP肽最佳浓度,可显著促进类骨质形成与骨标志物表达。
(2)QK肽修饰支架(PS/ACFs-QK)的促血管性能:
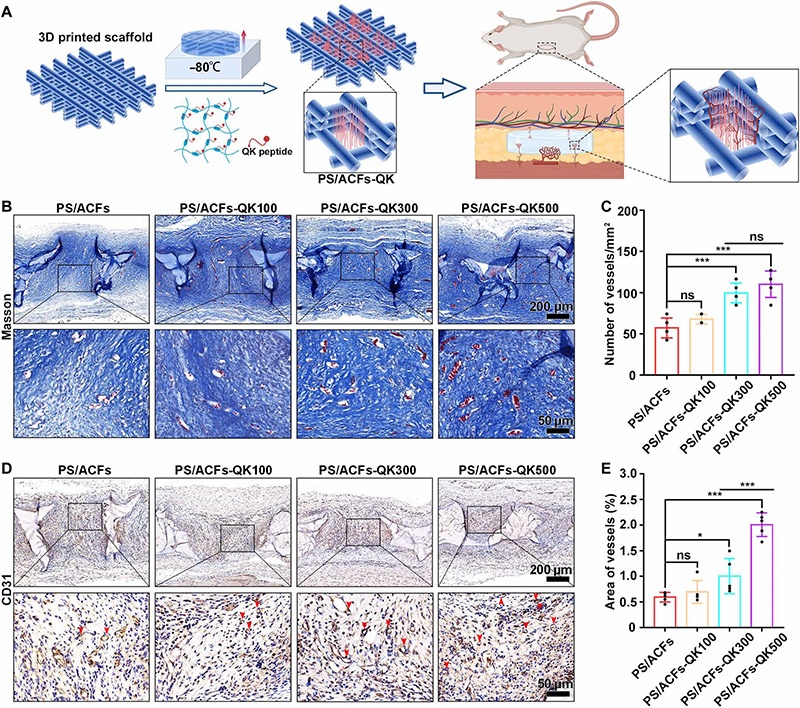
A:PS/ACFs-QK的制备流程与大鼠皮下植入模型评估示意图(n=4);
B:三色染色(2周):新生血管数量随QK肽浓度(100-500μg/ml)增加而增多;
C:新生血管数量定量:PS/ACFs-QK500组(500μg/ml)显著高于其他组;
D-E:CD31免疫组化染色与血管面积定量:PS/ACFs-QK300(300μg/ml)与QK500组新生血管面积高于PS与QK100组,且QK500组高于QK300组;
注:*P<0.05,***P<0.001,ns为无显著性差异。
结果表明:500μg/ml为QK肽最佳浓度,可通过模拟血管内皮生长因子(VEGF)功能,显著促进皮下植入区域的新生血管形成,为骨再生提供充足营养。
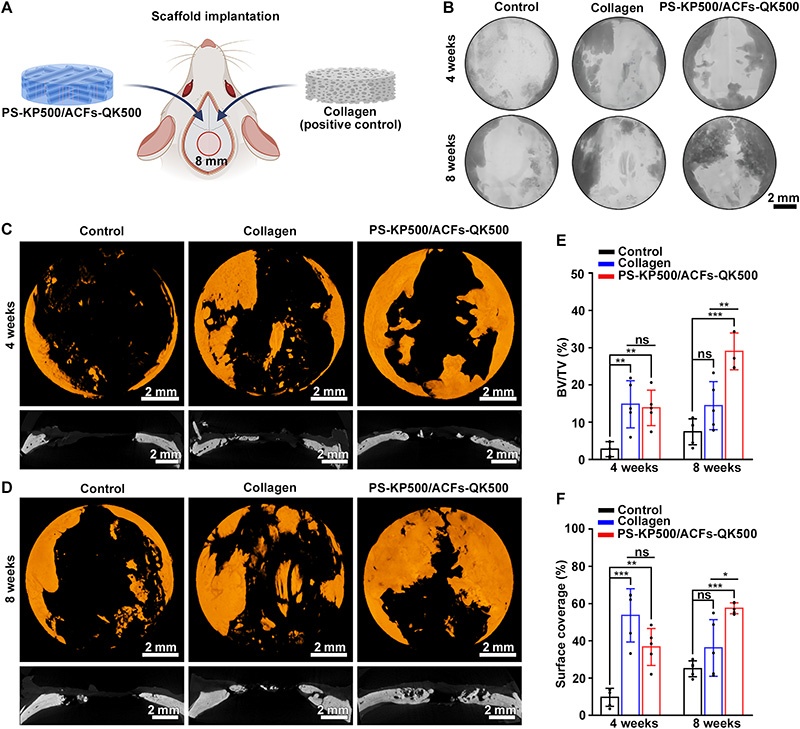
A:实验支架(PS-KP500/ACFs-QK500)与胶原海绵(阳性对照)植入大鼠8mm直径临界尺寸颅骨缺损的示意图(n=5);
B:X线原始图像(4、8周):PS-KP500/ACFs-QK500与胶原海绵组的缺损区域新生骨多于对照组;
C-D:Micro-CT 3D重建图与冠状位图像(4、8周):PS-KP500/ACFs-QK500组8周时新生骨体积与分布更优;
E-F:定量分析(4、8周):4周时两组骨体积分数(BV/TV)与表面覆盖率无显著差异;8周时PS-KP500/ACFs-QK500组显著高于胶原海绵组;
注:*P<0.05,**P<0.01,***P<0.001,ns为无显著性差异。
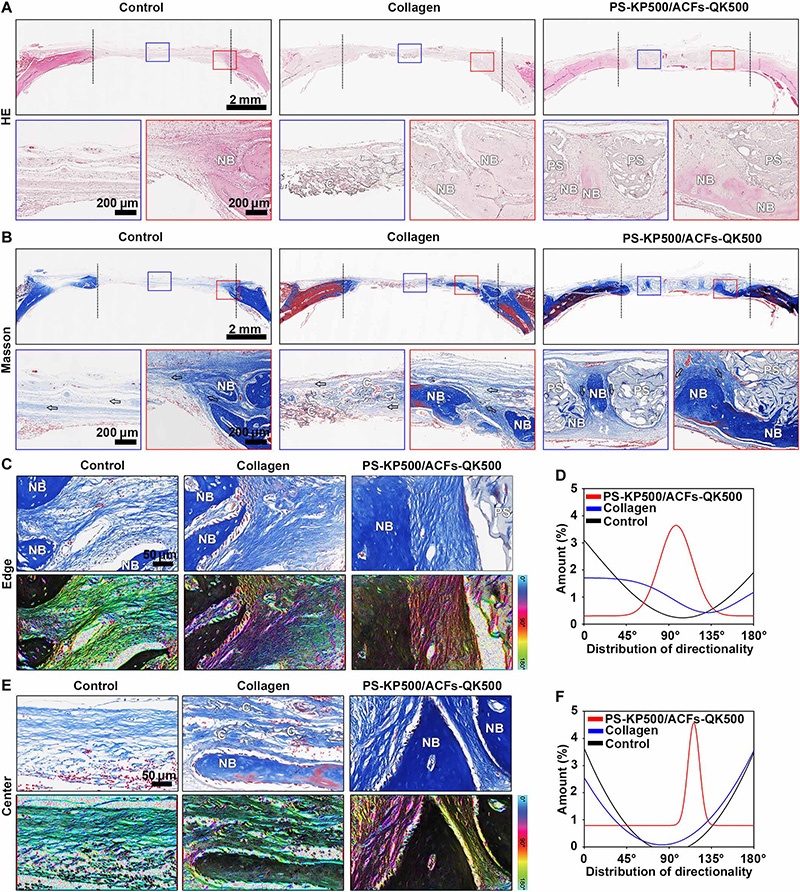
A-B:H&E与三色染色(n=5):PS-KP500/ACFs-QK500与胶原海绵组缺损区域可见更多新生骨(NB)有机基质,对照组极少;PS-KP500/ACFs-QK500组检测到垂直定向胶原纤维(由ACFs引导),且纤维内形成脱钙有机骨基质;
C-F:缺损边缘与中心区域新生软组织的三色染色与角度分布:对照组与胶原海绵组胶原组织水平排列,PS-KP500/ACFs-QK500组呈垂直排列;
注:NB为新生骨,C为胶原海绵,PS为3D打印支架。
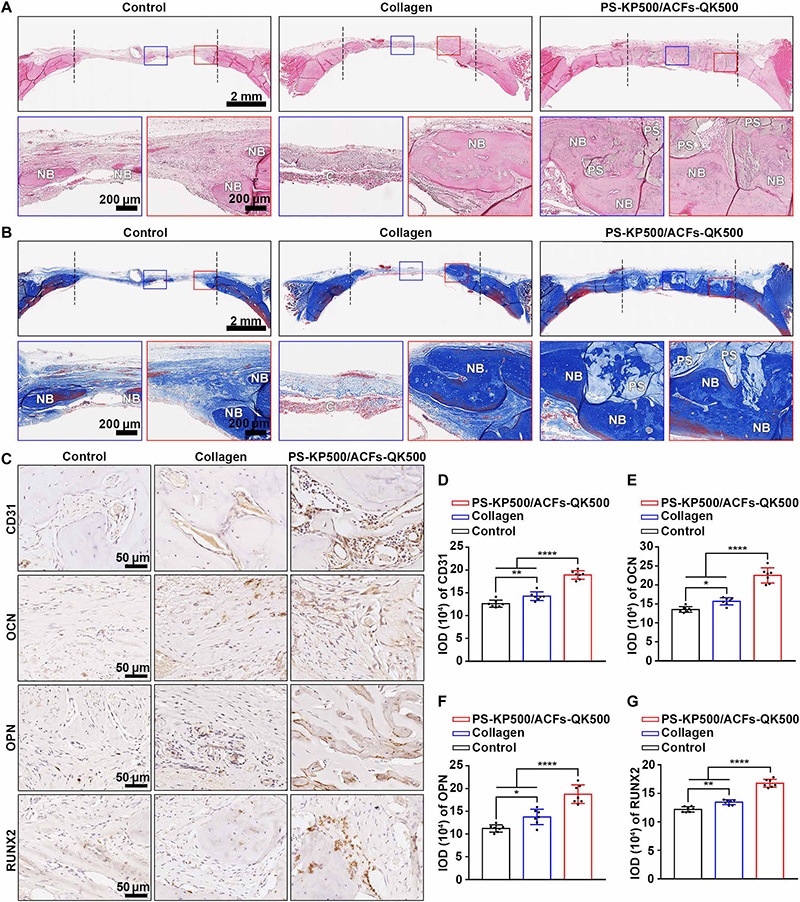
A-B:H&E与三色染色(n=5):8周时PS-KP500/ACFs-QK500组缺损区域新生有机骨基质最多,且支架区域(PS)被新生骨包裹;
C:免疫组化染色(CD31、OCN、OPN、RUNX2):PS-KP500/ACFs-QK500组的血管标志物(CD31)与成骨标志物(OCN、OPN、RUNX2)表达最高;
D-G:积分光密度定量:PS-KP500/ACFs-QK500组的CD31、OCN、OPN、RUNX2相对表达量显著高于胶原海绵与对照组;
注:*P<0.05,**P<0.01,****P<0.0001,RUNX2为 Runt相关转录因子2(成骨关键转录因子)。
关键发现:
| 类别 | 关键参数/步骤 |
|---|---|
| 核心材料 | 甲基丙烯酰化明胶(Gel-MA)、KP肽(BMP-2模拟肽)、QK肽(VEGF模拟肽)、胶原海绵(阳性对照) |
| 支架制备 | 3D打印参数:25号针头,层高0.2mm,线距1.2mm,打印速度6mm/s;定向冷冻温度-80℃,交联24小时 |
| 性能表征 | SEM(形貌)、Micro-CT(骨再生定量)、电子万能试验机(机械性能)、CCK-8(细胞活性) |
| 动物模型 | 大鼠皮下植入模型、裸鼠异位成骨模型、大鼠8mm临界尺寸颅骨缺损模型 |
| 组织学分析 | H&E染色、三色染色、免疫组化(CD31/OCN/OPN/RUNX2)、TRAP染色(破骨细胞检测) |
全面解析森工DIW墨水直写3D打印机在该类研究中功能匹配情况及需定制功能,帮助用户更好地选择合适的3D打印设备及功能模块。
①紫外固化辅助成型:该模块辅助配备365nm/385m/395m/405m多种波长范围,有效辅助含光引发剂直写材料的辅助固化成型;
②墨水挤出打印:适合低粘度生物材料,如水凝胶、明胶等;
①可搭载低温直写喷头/平台模块该模块支持-5℃-室温,能快速提高固化效率,保障材料打印成型效果;
②可升级多通道打印头,实现协同打印不同材料和细胞液滴入进行培养;
③搭载转轴模块为不同直径、不同长度类型的管状支架提供更多实验空间;
④为了提高实验效率,可使用在线混合模块,将生物材料与特定性能材料进行实时比混合,在多喷头协作时间同时满足更多不同打印方式;
①低温直写喷头/平台模块:支持-5℃~室温,喷头料筒满载容量10cc,独立分布式控温,打印材料在料筒及针尖均可实现精确温控;低温平台实现模块化冷井设计,支持对玻片、孔板(6、12、24、48、96孔)直接使用,有效制冷区域尺寸:90mm*90mm*75mm;控温范围:-5℃-室温
②多通道打印头: 2-4通道设计,可装载多材料进行协同/并联打印,如通过设备移液功能,同时进行细胞溶液滴入,提高实验效率;
③转轴模块:旋转轴直径支持:φ1.5 φ2 φ4 φ6 φ8 φ10 φ20 φ25 旋转轴打印长度:φ1.5 φ2 φ4 φ6 φ8 φ10 可打印长度100mm,φ20 φ25 可打印长度95mm;满足更多不同规格直径需求,实现多种个性化组织支架打印;
④在线混合模块:主动混合或者被动混合模式,可实时在线混合,实现指定比例混合材料、在线梯度渐变;
由于小编学识所限,文中内容难免存在疏漏或不足之处。若您发现任何错误或值得商榷的观点,恳请不吝指正,
小编将第一时间修正完善。感谢您的包容与支持!
本文内容来源于网络公开素材,发布的目的在于学术交流、研讨分享,
如相关内容涉及侵权,请联系我们,将第一时间下架内容!


3D打印高性能Ag/BaTiO₃陶瓷-聚合物压电传感器,赋能生物医学应用
用于3D打印分层多孔电极的Co₃O₄/CeO₂高性能墨水,助力固态超级电容器能量密度跃升
基于直写式垂直 3D 打印技术、嵌入多个人工机械感受器的防水纤毛电子皮肤及其在船员健康管理中的应用

再传喜报,森工AutoBio1000直写3D打印设备助力华师大&韩国KAIST科研团队在材料科学顶刊发表高水平论文

关于不法分子冒用“森工科技”实施APP诈骗的严正声明
Structural-engineered V₂O₅/MoO₃ nanocomposite scaffolds via direct ink writing 3D printing for asymm