
创伤、感染或肿瘤切除导致的临界尺寸骨缺损是临床治疗的重大难题。目前的金标准治疗方案(如自体移植、异体移植)受限于供体短缺、免疫并发症及感染风险,亟需合成替代材料。
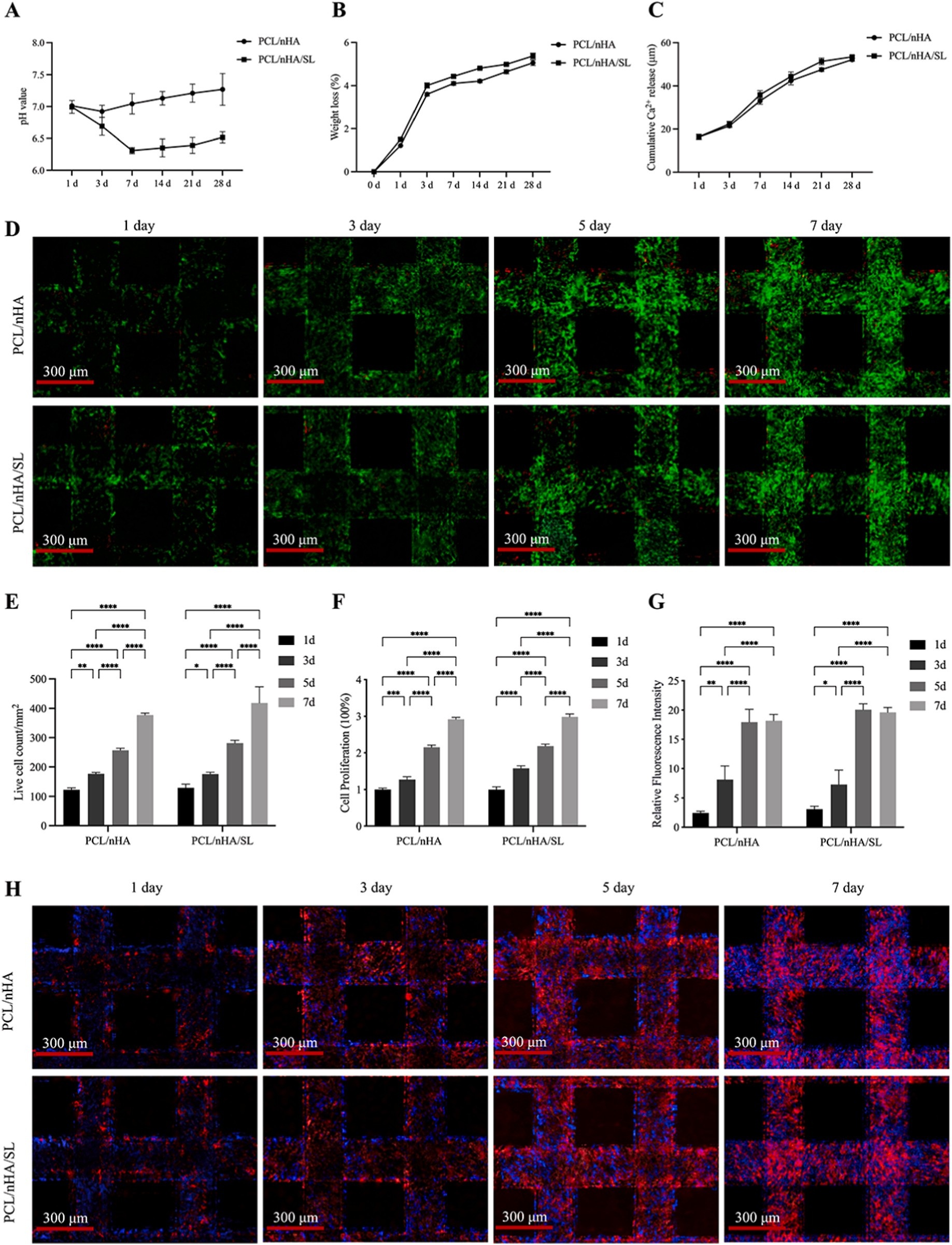
组织工程策略(仿生支架结合干细胞)具有治疗潜力,但仍存在未解决的问题:① 聚己内酯(PCL)支架虽具备可调节降解性、力学耐久性及监管批准资质,但其固有疏水性和低生物活性需与生物活性成分(如天然骨主要无机成分纳米羟基磷灰石nHA)复合;② 现有支架设计无法复刻天然骨组织的动态代谢相互作用;③ 常规常氧体外培养会损害骨髓间充质干细胞(BMSCs)的干性和成骨能力,而缺氧骨髓微环境可通过代谢适应维持这些特性。
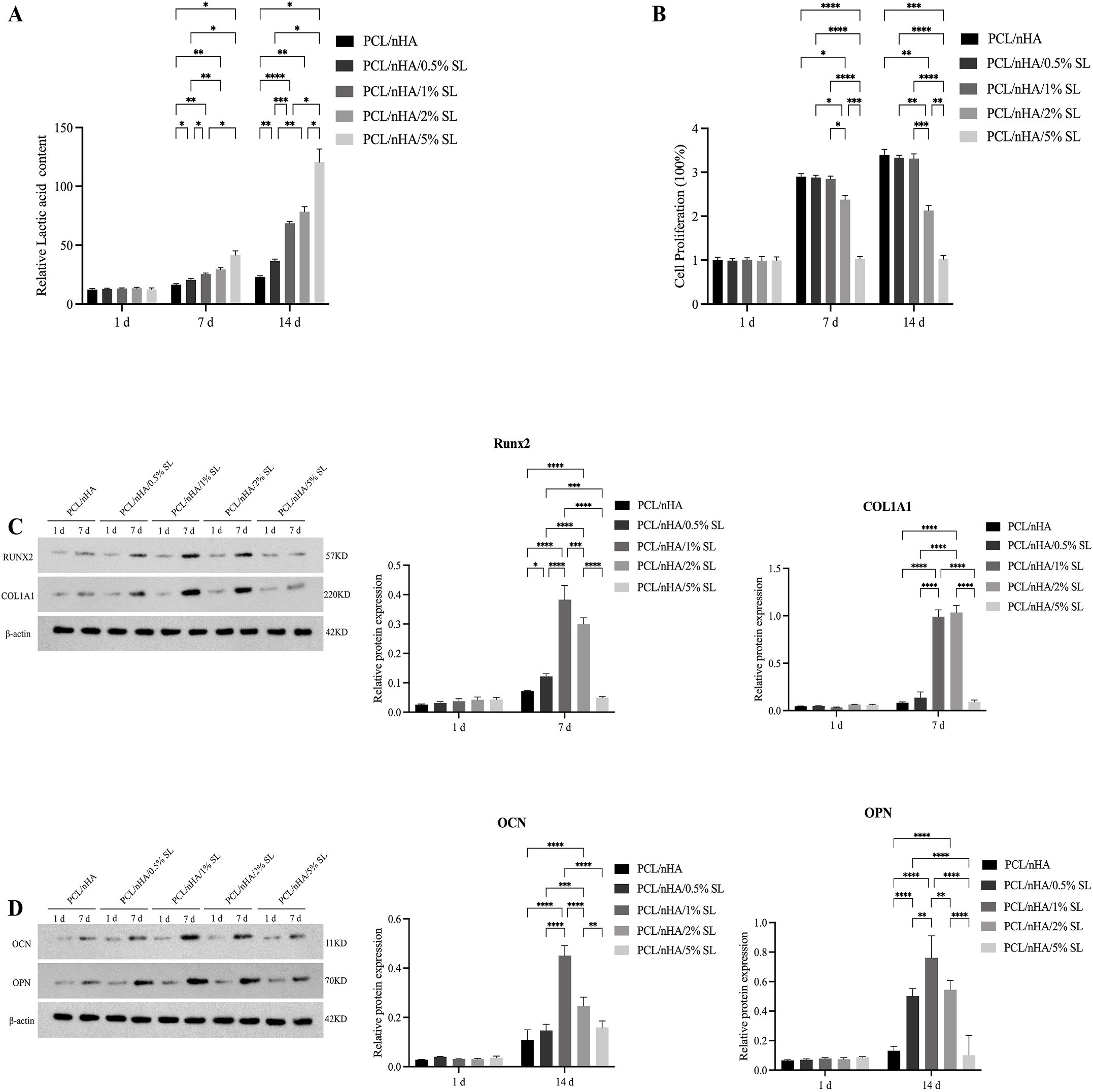
乳酸在骨生物学中具有细胞类型依赖性双重作用:对BMSCs可通过组蛋白H3K18乳酸化或嗅觉受体Olfr1440激活发挥促成骨作用,但对牙周膜干细胞则通过MCT1-mTOR介导的自噬抑制抑制成骨;同时乳酸还可调控免疫重编程(如诱导巨噬细胞向M2型极化)。然而,当前研究存在三大空白:① 尚无支架设计利用乳酸的促成骨潜力;② 组蛋白乳酸化以外的机制未被探索;③ 乳酸对成骨关键调控因子(如RUNX2)的影响未知。
采用溶剂浇铸结合3D打印技术制备PCL/nHA/SL复合支架,具体参数如下:
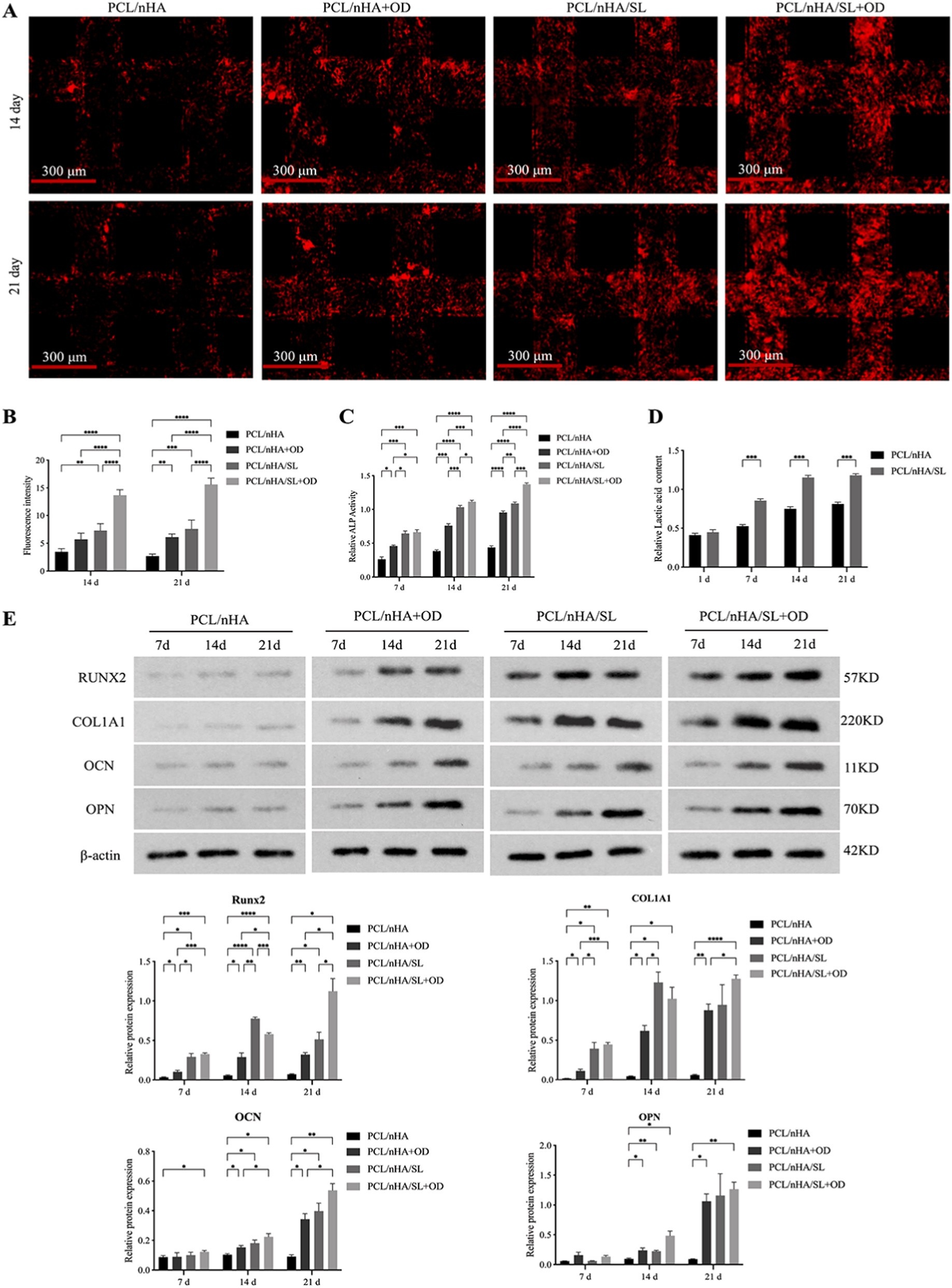
使用人BMSCs(ATCC® PCS-500-012™),在含10%胎牛血清(FBS)和1%青霉素/链霉素的DMEM培养基中培养(37℃、5% CO₂),选用第3代细胞进行实验;支架接种密度为4×10⁴个细胞/支架,分别采用基础培养基或成骨诱导培养基(含0.1 mM地塞米松、8 mM β-甘油磷酸钠、50 μg/mL抗坏血酸)培养,每3天换液。
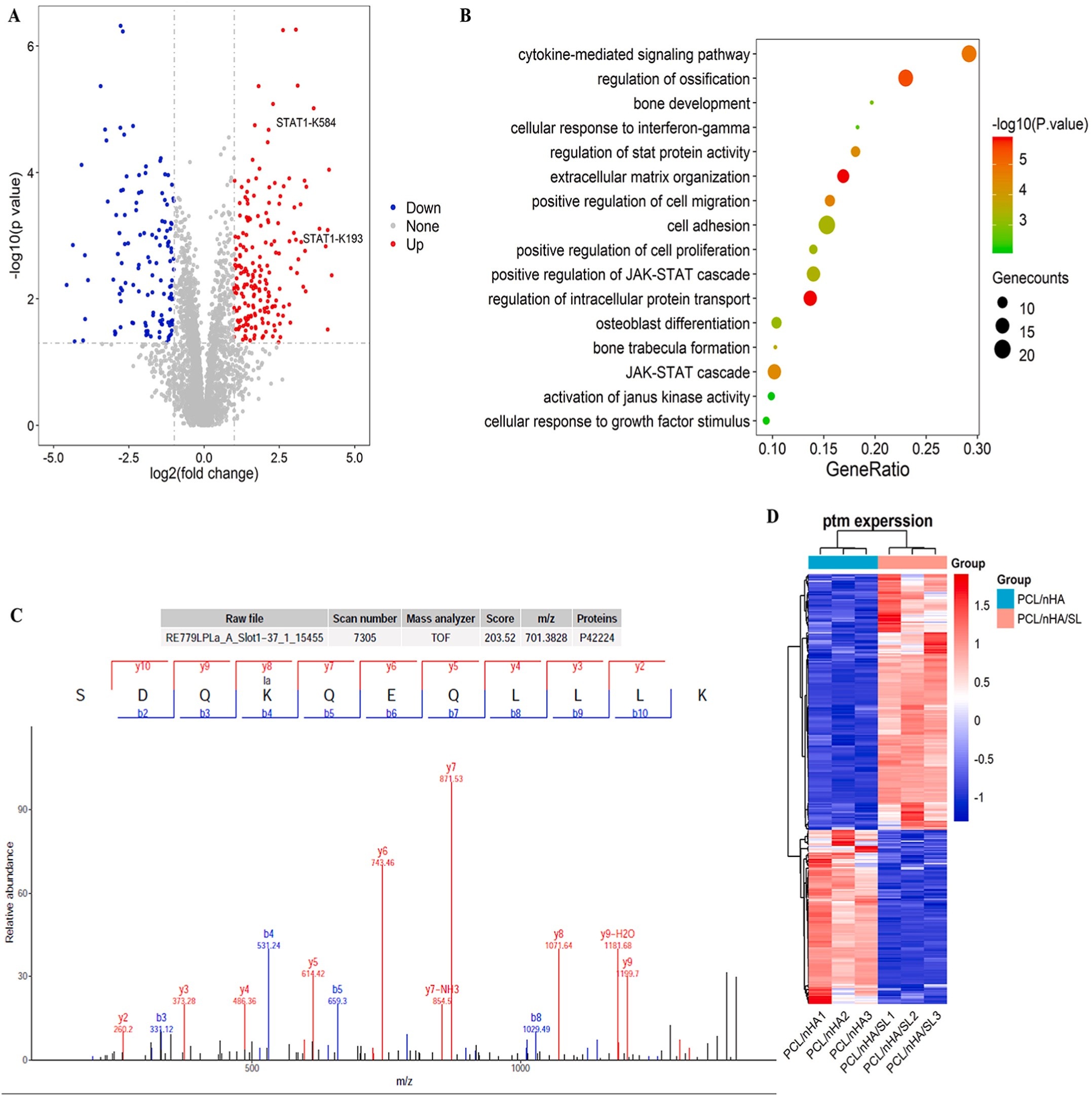
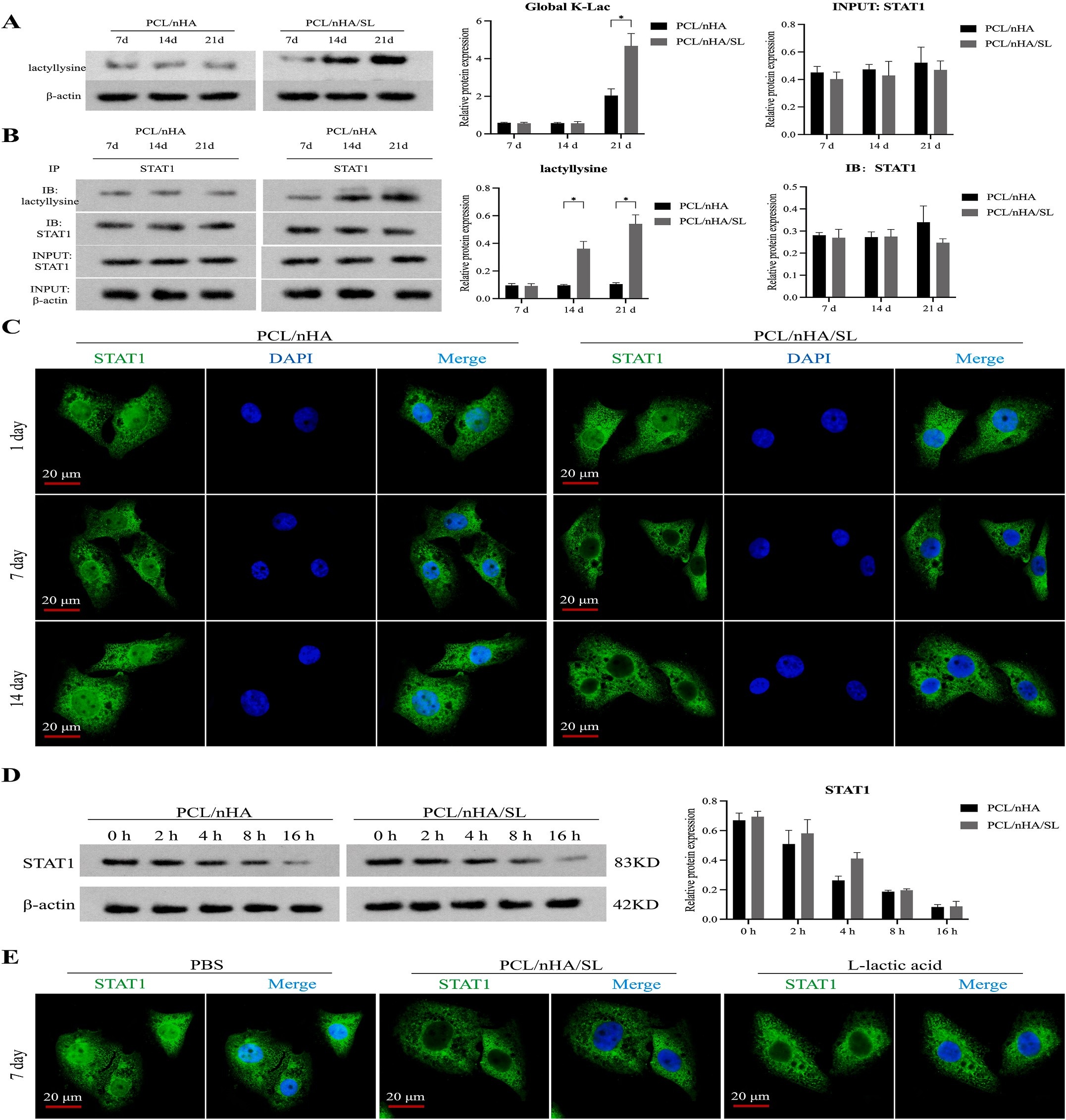
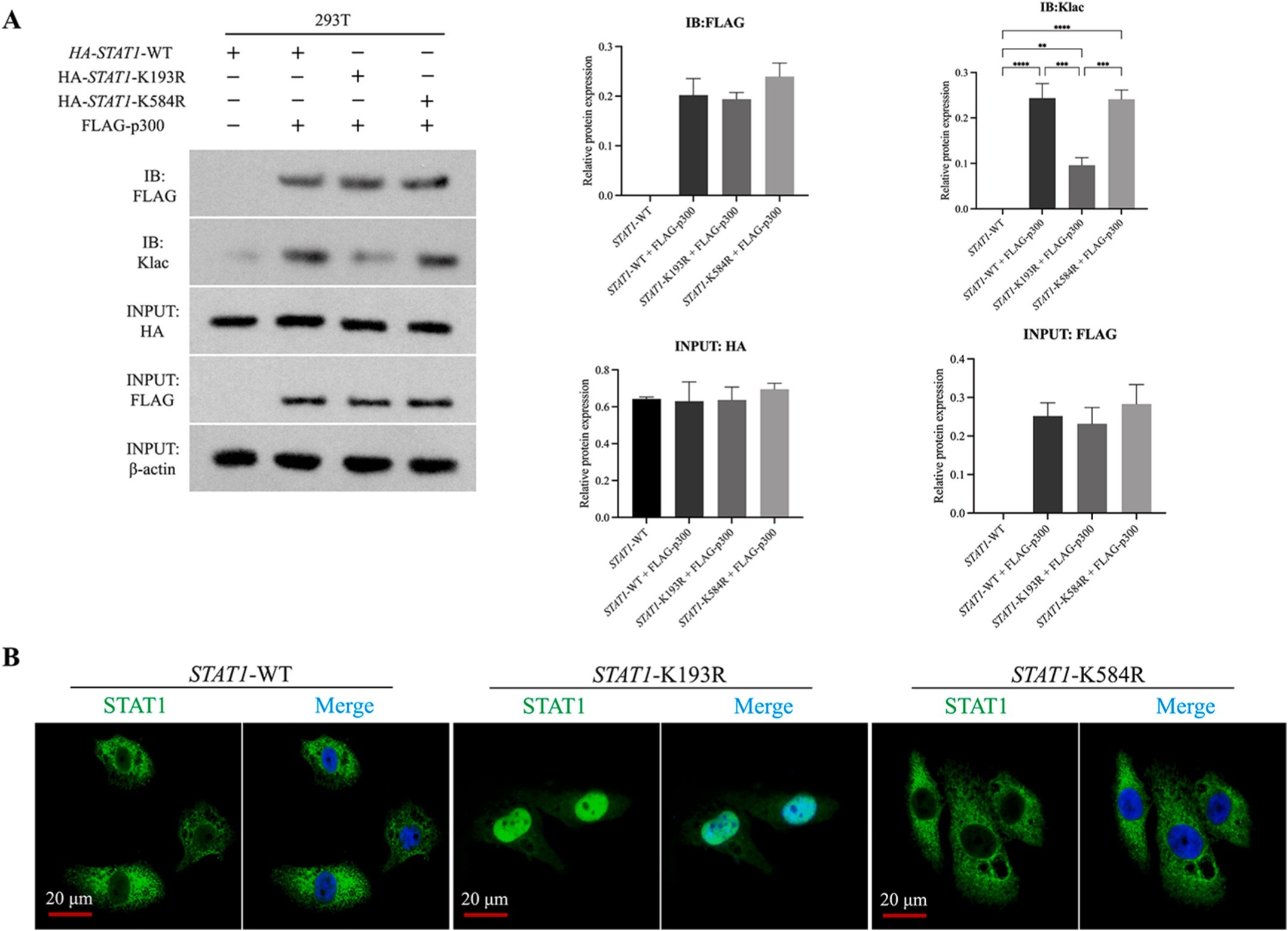
BMSCs在PCL/nHA/SL或PCL/nHA支架上培养14天后,提取蛋白并胰酶消化,采用抗K-Lac抗体偶联磁珠富集乳酸化肽段,通过4D无标记LC-MS/MS(timsTOF Pro质谱仪,Bruker)分析;使用MaxQuant(v1.6.15.0)匹配UniProt人类数据库(2022),筛选差异乳酸化位点(FC>1.5,P<0.05),并进行GO/KEGG富集分析(Fisher精确检验,P<0.05);手动验证STAT1-K193乳酸化(Mascot评分>200,定位概率>99%)。
采用慢病毒转染(MOI=20,2 μg/mL聚凝胺孵育72小时)进行基因修饰,设计两组关键实验:
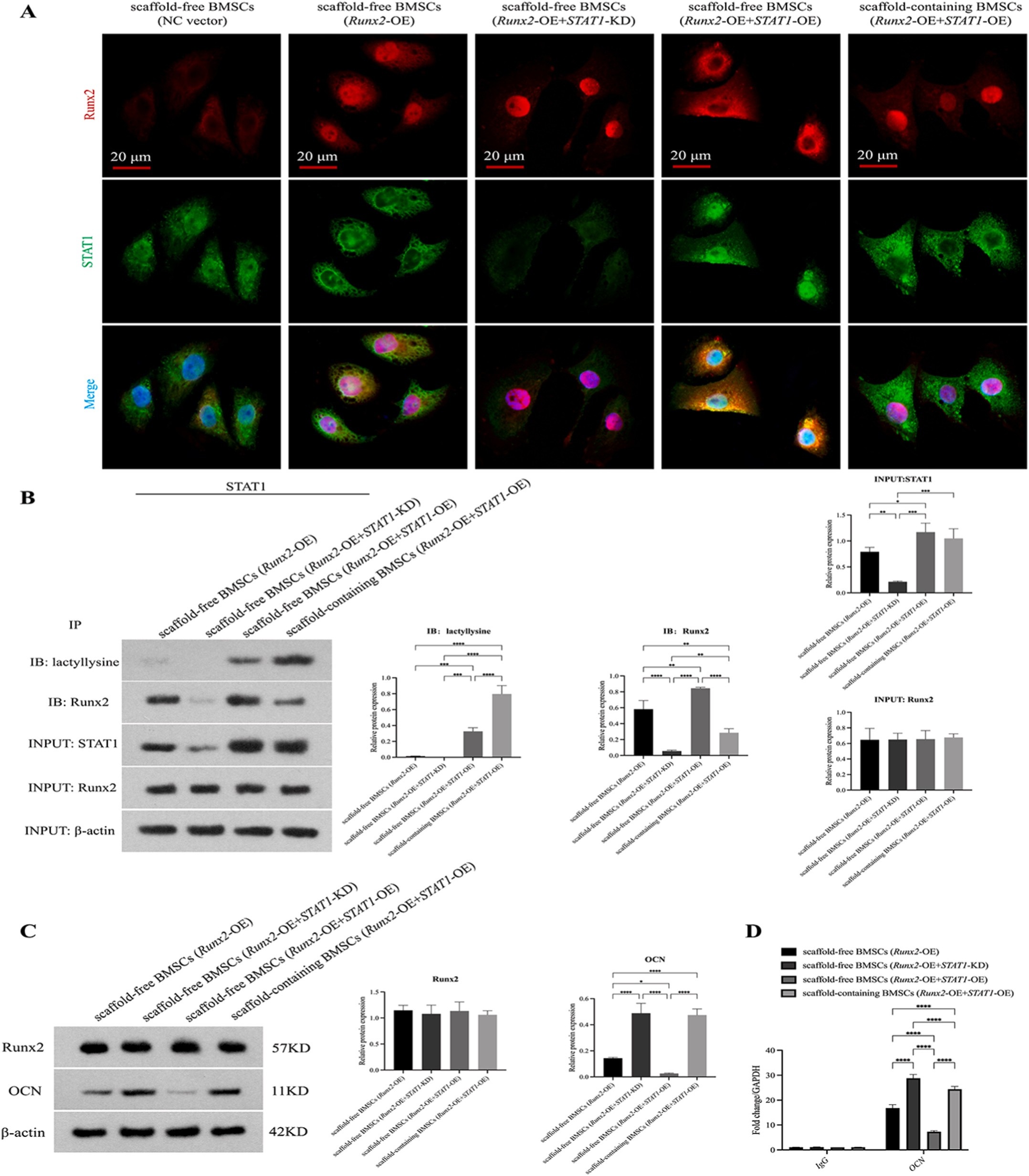
实验1:STAT1乳酸化对STAT1-Runx2相互作用的影响(Table 1)
| 组别 | 实验设计详情 |
|---|---|
| 无支架BMSCs(NC载体) | 转染空载体的无支架BMSCs(基线对照) |
| 无支架BMSCs(Runx2-OE) | 过表达Runx2的无支架BMSCs(pLVX-Runx2) |
| 无支架BMSCs(Runx2-OE+STAT1-KD) | 过表达Runx2且敲低STAT1的无支架BMSCs(shSTAT1) |
| 无支架BMSCs(Runx2-OE+STAT1-OE) | 过表达Runx2且过表达野生型STAT1的无支架BMSCs(pLVX-STAT1-WT) |
| 有支架BMSCs(Runx2-OE+STAT1-OE) | 过表达Runx2且过表达野生型STAT1的BMSCs,接种于PCL/nHA/SL支架 |
转染后48小时进行机制检测:免疫荧光检测STAT1/Runx2共定位;Co-IP(STAT1抗体 pull-down)检测乳酸化和Runx2结合;ChIP-qPCR检测Runx2与骨钙素启动子的结合;Western blot检测Runx2和OCN表达(GAPDH归一化)。
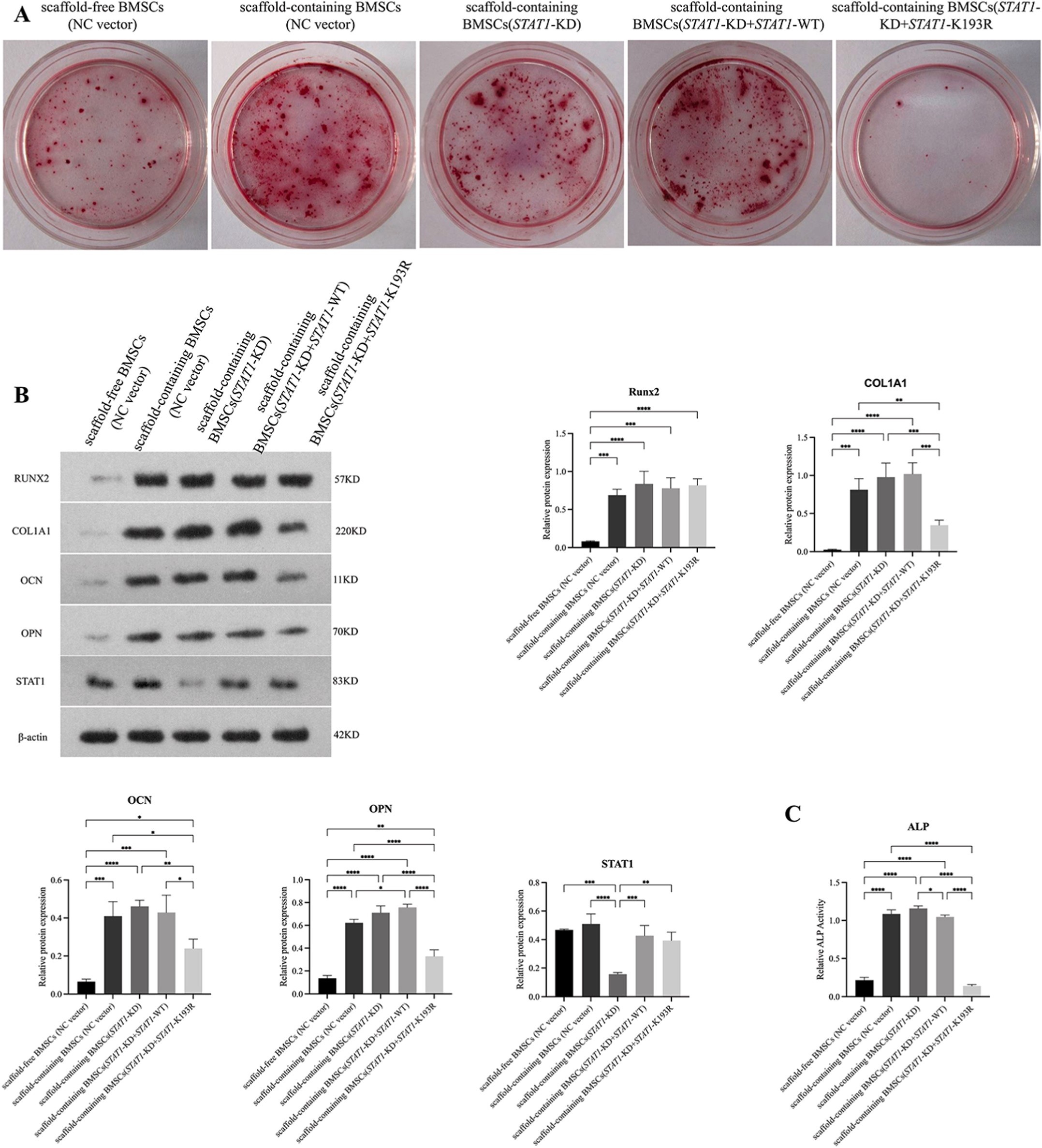
实验2:STAT1-K193R对乳酸诱导成骨的影响(Table 2)
| 组别 | 实验设计详情 |
|---|---|
| 无支架BMSCs(NC载体) | 无支架的BMSCs(阴性对照) |
| 有支架BMSCs(NC载体) | 接种于PCL/nHA/SL支架的BMSCs(阳性对照) |
| 有支架BMSCs(STAT1-KD) | 敲低STAT1的BMSCs,接种于PCL/nHA/SL支架 |
| 有支架BMSCs(STAT1-KD+STAT1-WT) | 敲低STAT1后回补野生型STAT1的BMSCs,接种于PCL/nHA/SL支架 |
| 有支架BMSCs(STAT1-KD+STAT1-K193R) | 敲低STAT1后回补乳酸化缺陷型STAT1-K193R突变体的BMSCs,接种于PCL/nHA/SL支架 |
成骨诱导培养基培养14天后,检测ALP活性、ARS矿化及Western blot(Runx2、COL1A1、OCN、OPN),全程定量乳酸水平。
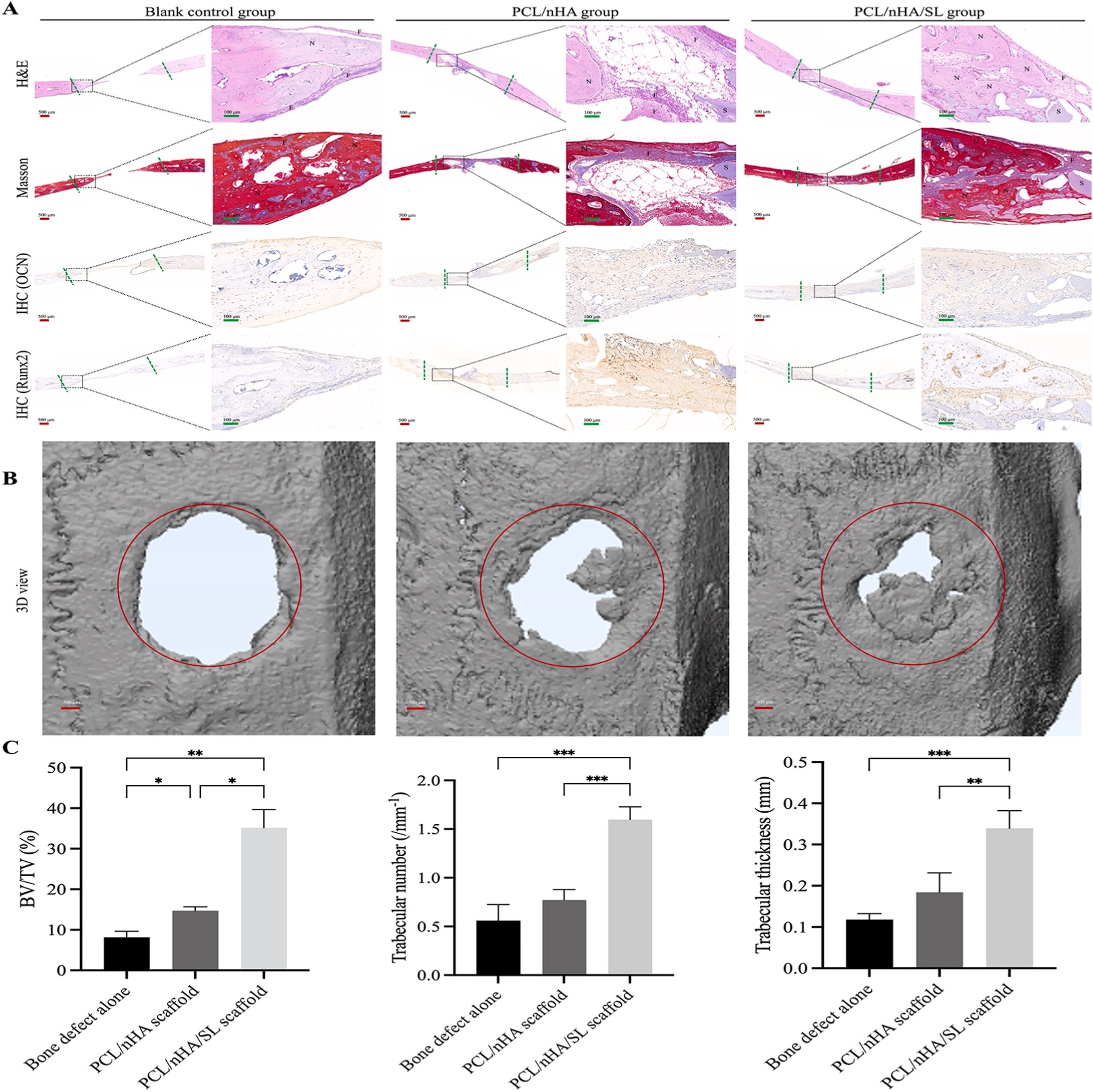
对SD大鼠(n=6/组)构建5 mm直径临界尺寸颅骨缺损模型,实验组植入支架,对照组不处理;12周后取材,4% PFA固定,采用:① 显微CT(Skyscan 1176)扫描,CTAn软件定量新骨形成(BV/TV、Tb.N、Tb.Th);② 组织学染色(HE、Masson三色染色);③ 免疫组化(OCN、RUNX2)。
数据以均值±标准差(n=3)表示,采用Student t检验或单因素方差分析(ANOVA)结合Tukey事后检验(GraphPad Prism 9.0),P<0.05为差异有统计学意义。
全面解析森工DIW墨水直写3D打印机在该类研究中功能匹配情况及需定制功能,帮助用户更好地选择合适的3D打印设备及功能模块。
1)、 DIW高温直写模块(室温-300℃),支持粉末、浆料、颗粒等形态材料,针对不同材料形态提供合适的打印策略;
2)、熔融沉积(FDM):为温敏性质材料结构模型提供打印帮助;
高温灭菌生物柜:可实现室温-60℃固化12小时,同时支持γ射线(25 kGy)灭菌消毒工作,有效防止材料污染;
1)、更精细化纳米级的仿生支架打印,可以使用静电纺丝/近场直写模块打印;
2)、可升级多通道打印头,实现协同打印不同材料和细胞液滴入进行培养;
1)、静电纺丝模块: 配置高压静电场,为生物溶液实现纳米级支架打印;
2)、多通道打印头: 2-4通道设计,可装载多材料进行协同/并联打印,如通过设备移液功能,同时进行细胞溶液滴入,提高实验效率;
3)、低温直写模块:模块支持-5℃-室温,精准温控,结合细胞生长所需环境,创造细胞友好型打印环境,提高存活率。
由于小编学识所限,文中内容难免存在疏漏或不足之处。若您发现任何错误或值得商榷的观点,恳请不吝指正,
小编将第一时间修正完善。感谢您的包容与支持!
本文内容来源于网络公开素材,发布的目的在于学术交流、研讨分享,
如相关内容涉及侵权,请联系我们,将第一时间下架内容!


3D打印高性能Ag/BaTiO₃陶瓷-聚合物压电传感器,赋能生物医学应用
用于3D打印分层多孔电极的Co₃O₄/CeO₂高性能墨水,助力固态超级电容器能量密度跃升
基于直写式垂直 3D 打印技术、嵌入多个人工机械感受器的防水纤毛电子皮肤及其在船员健康管理中的应用

再传喜报,森工AutoBio1000直写3D打印设备助力华师大&韩国KAIST科研团队在材料科学顶刊发表高水平论文

关于不法分子冒用“森工科技”实施APP诈骗的严正声明
Structural-engineered V₂O₅/MoO₃ nanocomposite scaffolds via direct ink writing 3D printing for asymm