

骨缺损由创伤、肿瘤或感染等因素引发,在临床治疗中是一项重大挑战。这类缺损常导致骨折延迟愈合、肌肉骨骼功能障碍等严重并发症,极大地影响患者的生活质量。当前主要的治疗策略包括自体移植、异体移植和人工支架植入,但这些方法均存在明显局限性。自体和异体移植物面临供体短缺、供区病损以及免疫排斥等问题,而骨缺损复杂且不规则的几何形状,进一步增加了这些方法的应用难度。
骨组织工程(BTE)的发展为加速骨再生带来了新的希望,3D打印支架凭借其能够精确定制内部结构以匹配缺损部位的优势,成为极具潜力的解决方案。与冷冻干燥和溶剂浇铸等传统支架制造方法产生的随机内部结构不同,3D打印的定制化设计显著增强了支架支持细胞生长和促进骨愈合的能力。
血管生成在骨再生过程中起着关键作用,它能促进成骨细胞活性,支持血管系统和矿化基质的同步发育。若缺乏有效的血管生成,血管浸润速度过慢,会导致细胞存活和骨组织形成所需的氧气和营养供应不足。因此,整合支架、细胞和信号分子的策略,对于同时增强成骨和血管生成、提高骨再生效果至关重要。
近年来,将多功能纳米材料引入支架以调节细胞行为并提供外部场响应性受到广泛关注。氧化铁纳米颗粒(IONPs)因其超顺磁性、良好的生物相容性、易于合成、纳米尺寸和低毒性等特性,在骨组织工程中展现出巨大潜力。此外,聚乳酸-乙醇酸共聚物(PLGA)作为一种经FDA批准的可生物降解聚合物,具有降解速率可调、生物相容性好以及可通过3D打印定制微观结构等优点。
尽管基于IONPs的骨支架在增强成骨和血管生成方面的潜力已得到认可,但相关潜在机制尚未完全明确。基于此,本研究旨在制备负载IONPs的3D打印PLGA支架,并探究其在静态磁场(SMF)下体内外促进成骨和血管生成的能力及相关分子机制。
1. 材料准备:从相关供应商处获取Fe₂O₃磁性纳米颗粒、PLGA、1,4-二氧六环等材料。将PLGA溶解在1,4-二氧六环中,浓度为15g/100mL,搅拌过夜后,分别加入0%、10%、20%和30%含量的Fe₂O₃磁性纳米颗粒,超声振荡使纳米颗粒均匀分散,得到不同比例的复合溶液。
2. 3D打印制备支架:采用低温挤出式3D打印技术,在-30℃下将复合溶液逐层喷射,喷嘴直径200μm,温度12℃,扫描速率22mm/s,喷丝填充速率0.3mm/s,支撑层厚度400μm,最终制成立方多孔支架。之后将支架在冷冻干燥机中冻干48h,再在37℃真空烘箱中干燥7天,以完全去除1,4-二氧六环,所得支架分别命名为PLGA、P10F、P20F和P30F。
3. 支架表征:
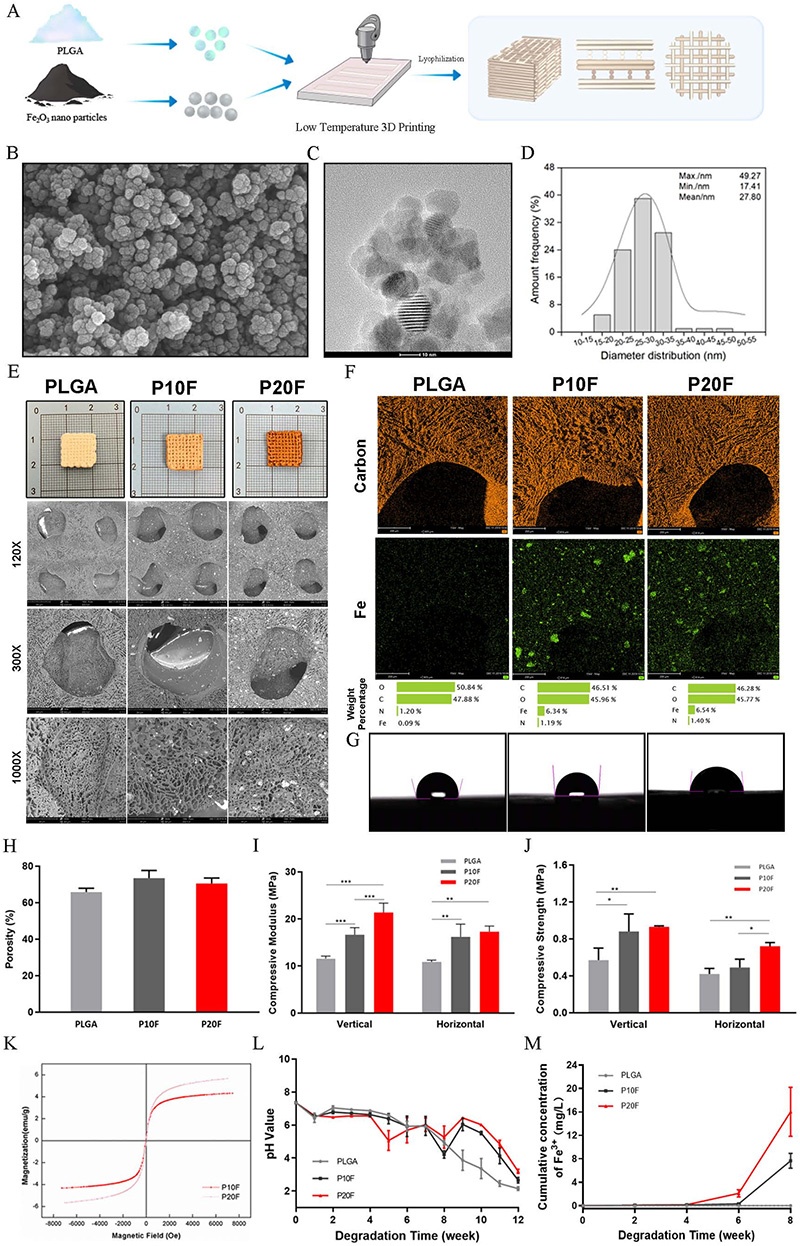
图1. PLGA/Fe₂O₃复合支架的制备与表征。A:支架制备流程;B:Fe₂O₃颗粒TEM图像;C:Fe₂O₃颗粒尺寸分布;D:不同支架的宏观照片和SEM图像;E:不同支架的元素分布图;F:水接触角测试结果;G:孔隙率测试结果;H:垂直方向压缩力学性能;I:水平方向压缩力学性能;J:饱和磁化强度;K:降解过程中pH值变化;L:降解过程中Fe³⁺释放量变化
1. 细胞培养:获取人骨髓间充质干细胞(hBMSCs)和人脐静脉内皮细胞(HUVECs),分别在相应的培养基中培养,hBMSCs使用添加10%胎牛血清(FBS)和1%青霉素/链霉素的MSC培养基,HUVECs使用添加10%FBS和1%青霉素-链霉素的高糖杜氏改良 Eagle 培养基(DMEM),在37℃、5%CO₂环境下培养,选用3-5代的hBMSCs和达到80-90%汇合度的HUVECs进行后续实验。
2. 细胞相容性检测:
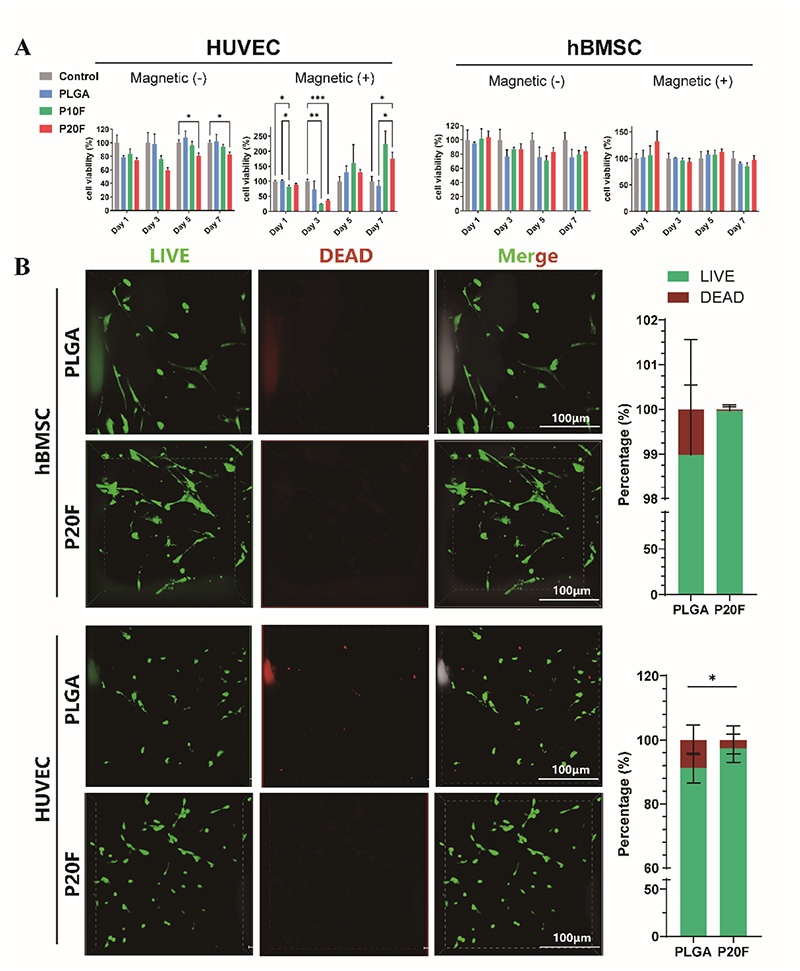
图2. PLGA/Fe₂O₃支架在有无磁场刺激下的体外细胞相容性。A:不同时间点HUVECs和BMSCs在不同支架上的细胞活力(CCK-8法);B:BMSCs和HUVECs在PLGA和P20F支架上培养3天后的活/死染色图像及定量分析(绿色:活细胞;红色:死细胞;比例尺:100μm)
3. 成骨分化相关实验:
4. 血管生成相关实验:
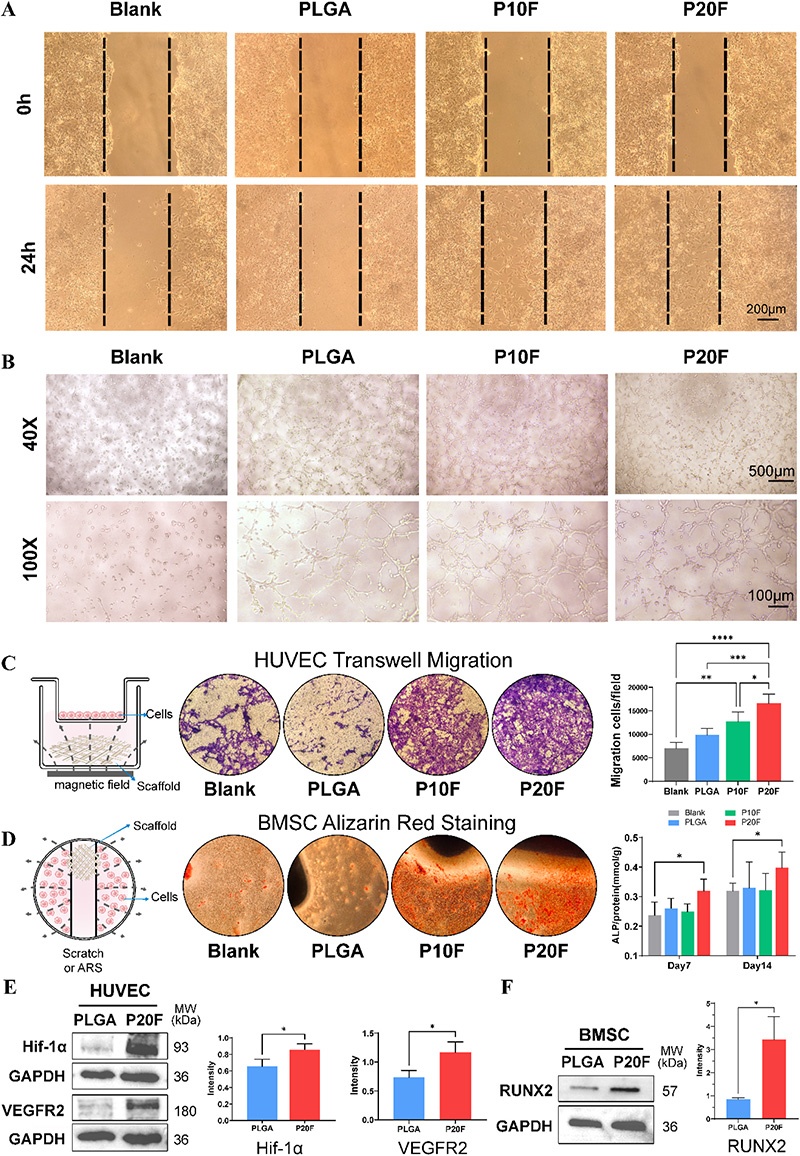
图3. 磁场刺激下PLGA/Fe₂O₃支架的体外成骨和血管生成潜力评估。A:HUVECs在不同支架上的划痕愈合实验图像(0h和24h);B:HUVECs在支架提取物作用下的管形成实验图像(40×和100×放大倍数);C:HUVECs的Transwell迁移实验结果及定量分析;D:BMSCs在不同支架上培养14天的茜素红S染色图像及不同时间点ALP活性定量分析;E:HUVECs中HIF-1α和VEGFR2表达的Western blot分析及定量;F:BMSCs中RUNX2表达的Western blot分析及定量
5. Fe³⁺和IONPs作用探究:制备与6周(3mg/L Fe³⁺)和8周(16mg/L Fe³⁺)累积Fe³⁺释放量相当的FeCl₃溶液,以及相同摩尔铁含量的IONPs悬浮液,分别与hBMSCs和HUVECs共培养,检测细胞活力、ALP活性、矿化情况及细胞迁移能力,以区分Fe³⁺和IONPs的作用。
1. 动物模型建立:选取新西兰兔,随机分为对照组、PLGA组和P20F组。通过腹腔注射戊巴比妥钠和异氟醚麻醉兔子,在双侧股骨远端髁处制造直径10mm、深度1.5cm的骨缺损隧道,将相应支架植入隧道。术后腹腔注射青霉素预防感染,在兔子笼底部均匀布置钕铁硼(NdFeB)永磁体,以产生覆盖整个活动区域的均匀静态磁场,使兔子在自由活动时持续接受磁场刺激。
2. 样本采集与处理:术后6周和12周,用异氟醚麻醉兔子,分离股骨髁,一部分用于micro-CT分析,另一部分固定、脱钙后用于组织学分析。
3. micro-CT分析:
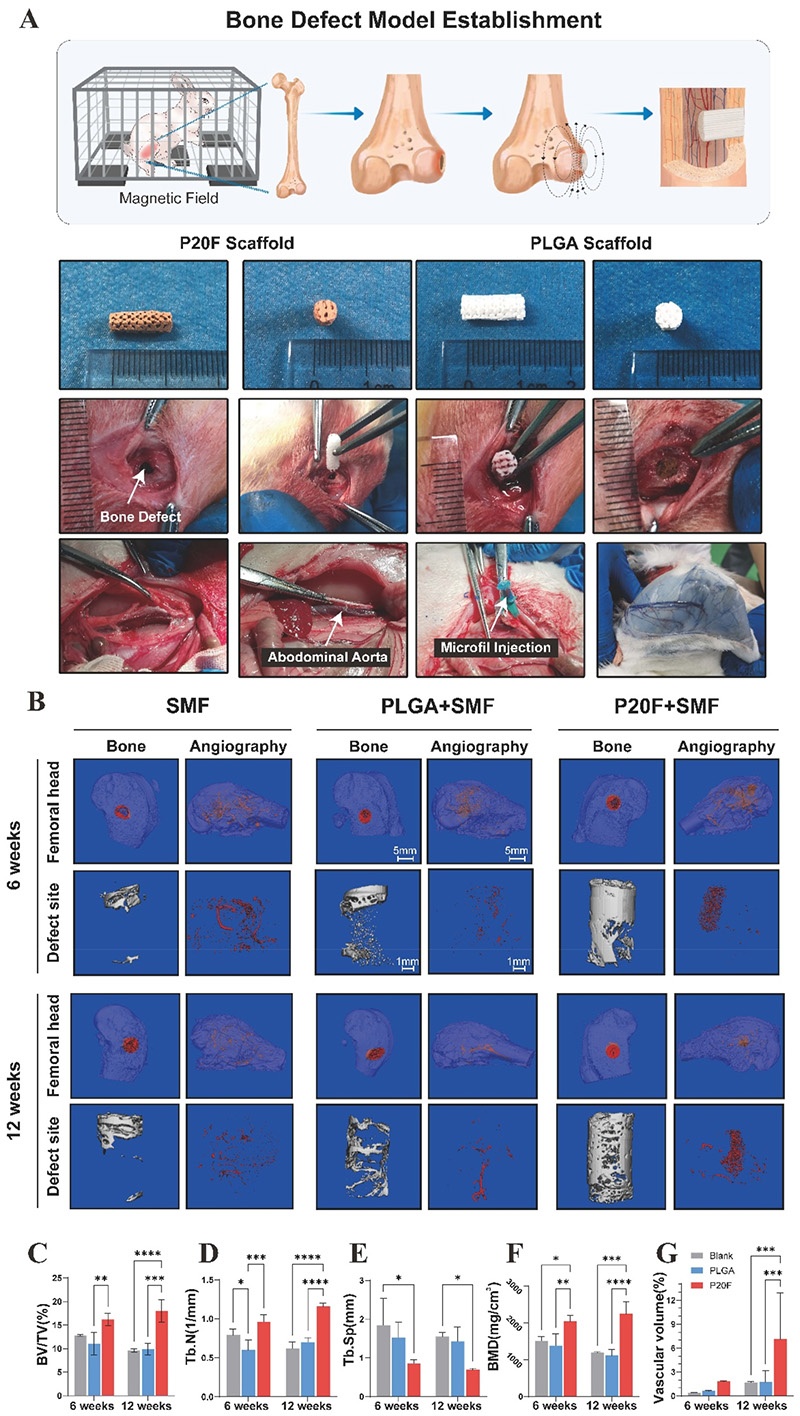
图4. 静态磁场刺激下兔股骨缺损模型的体内骨再生和血管生成评估。A:手术设计示意图及支架植入过程;B:术后6周和12周股骨缺损区域骨和血管的micro-CT三维重建图像;C-F:不同时间点骨体积相关参数(BV/TV、Tb.N、Tb.Sp、BMD)的定量分析;G:不同时间点血管体积的定量分析
4. 组织学分析:将收集的标本固定、脱钙、包埋在石蜡中,切成5μm厚的切片,进行Goldner三色染色和免疫组织化学染色,检测OCN(成骨细胞活性和骨形成标志物)、CD31(内皮细胞标志物)和VEGFA(血管生成活性标志物)的表达,由独立技术人员对切片进行编码,两名独立观察者进行评分和定量分析。
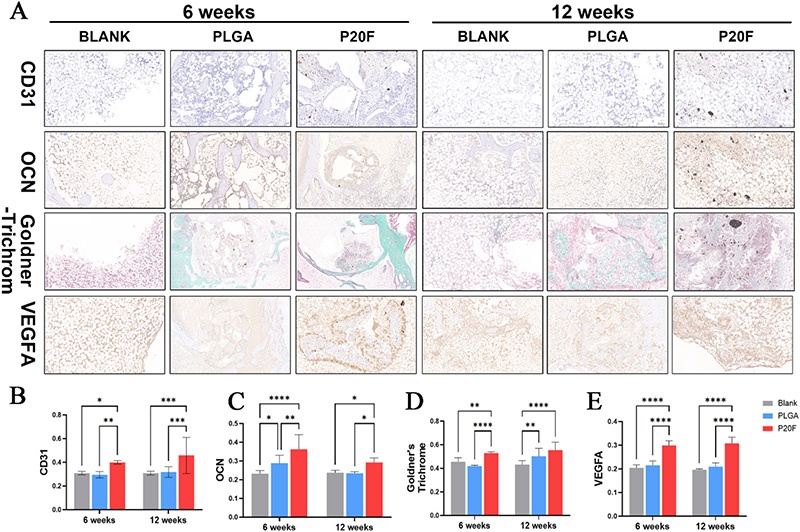
图5. 植入后6周和12周体内血管生成和成骨的组织学和免疫组织化学评估。A:空白组、PLGA组和P20F组股骨缺损部位的组织学和免疫组织化学染色图像(CD31、OCN、VEGFA染色及Goldner三色染色);B-E:6周和12周时CD31、OCN、Goldner三色染色及VEGFA免疫组织化学染色的平均光密度(MOD)定量分析
1. 蛋白质提取与质谱分析:将hBMSCs和HUVECs与不同组支架共培养48h后,提取总蛋白,采用过滤器辅助样品制备(FASP)方案进行蛋白质纯化和酶解,通过Q Exactive质谱仪结合Easy-nLC 1000系统进行质谱分析。
2. 数据分析:使用MaxQuant软件处理原始数据,采用目标-诱饵搜索策略进行肽段和蛋白质鉴定,控制假发现率(FDR)<1%。通过双侧t检验计算p值,筛选出p<0.05且倍数变化(FC)>1.5或<1/1.5的差异表达蛋白(DEPs)。对DEPs进行基因本体论(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析,可视化前20个显著富集的GO术语和KEGG通路。
1. Western blot验证:提取不同处理组细胞的总蛋白和核蛋白,采用BCA蛋白测定试剂盒检测蛋白浓度,通过SDS-PAGE凝胶电泳分离蛋白,转移到PVDF膜上,封闭后加入一抗孵育过夜,再加入HRP标记的二抗孵育,使用增强化学发光检测系统可视化蛋白条带,并用ImageJ软件分析,以GAPDH和纽蛋白作为内参。
2. 免疫共沉淀(Co-IP)实验:hBMSCs与PLGA或P20F支架共培养24h后,收集总蛋白裂解物,与抗CRYAB抗体孵育过夜,使用Thermo Scientific™ Pierce™ Magnetic IP/Co-IP试剂盒进行免疫沉淀,免疫沉淀复合物经SDS-PAGE和Western blot分析,检测CRYAB与β-连环蛋白的相互作用。
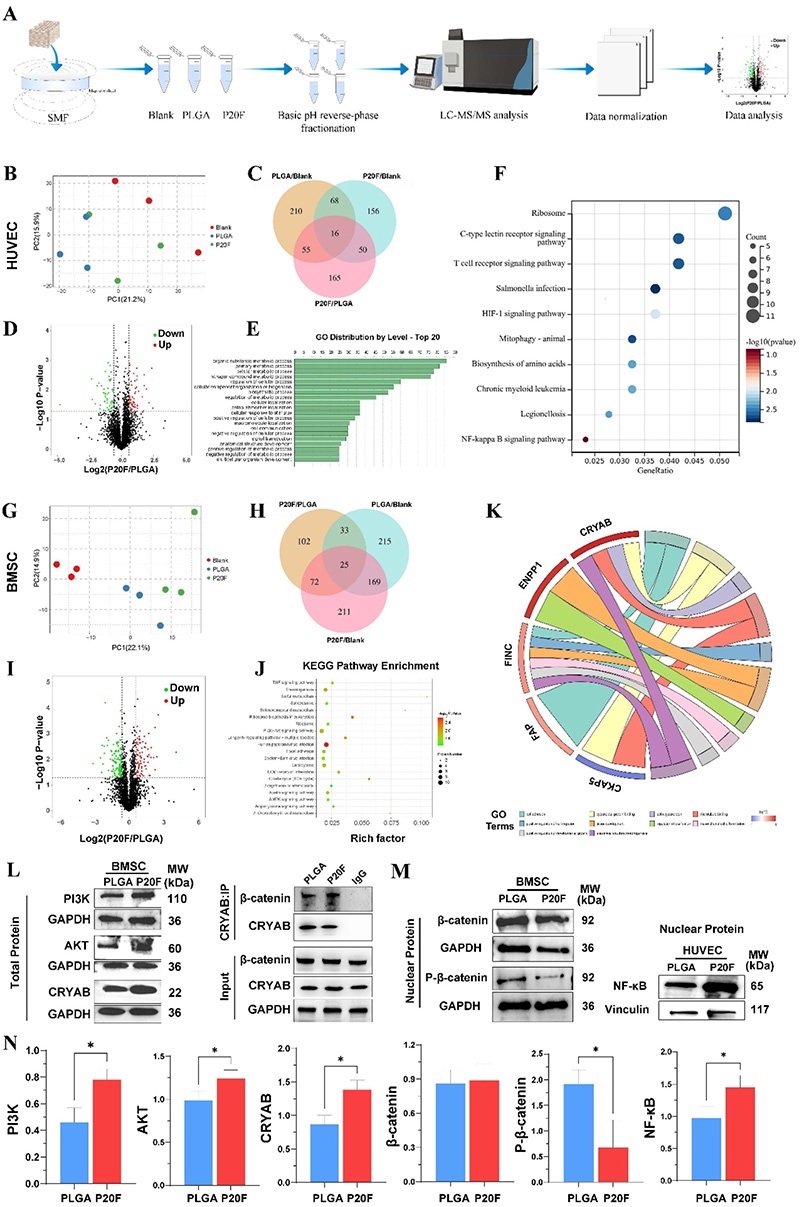
图6. 静态磁场刺激下PLGA/20%Fe₂O₃支架激活的血管生成和成骨通路的蛋白质组学分析及机制验证。A:蛋白质组学分析流程;B:HUVECs中不同组的主成分分析(PCA);C:HUVECs中差异表达基因的韦恩图;D:HUVECs中P20F与PLGA组的火山图;E:GO术语分布;F:HUVECs中KEGG通路富集分析及基因与GO术语关联;G:BMSCs中不同组的PCA;H:BMSCs中差异表达基因的韦恩图;I:BMSCs中P20F与PLGA组的火山图;J:BMSCs中GO富集分析;K:BMSCs中GO术语-蛋白质相互作用图;L:BMSCs中PI3K、AKT、CRYAB、β-连环蛋白表达的Western blot分析及Co-IP实验结果;M:BMSCs和HUVECs中相关蛋白表达的定量分析
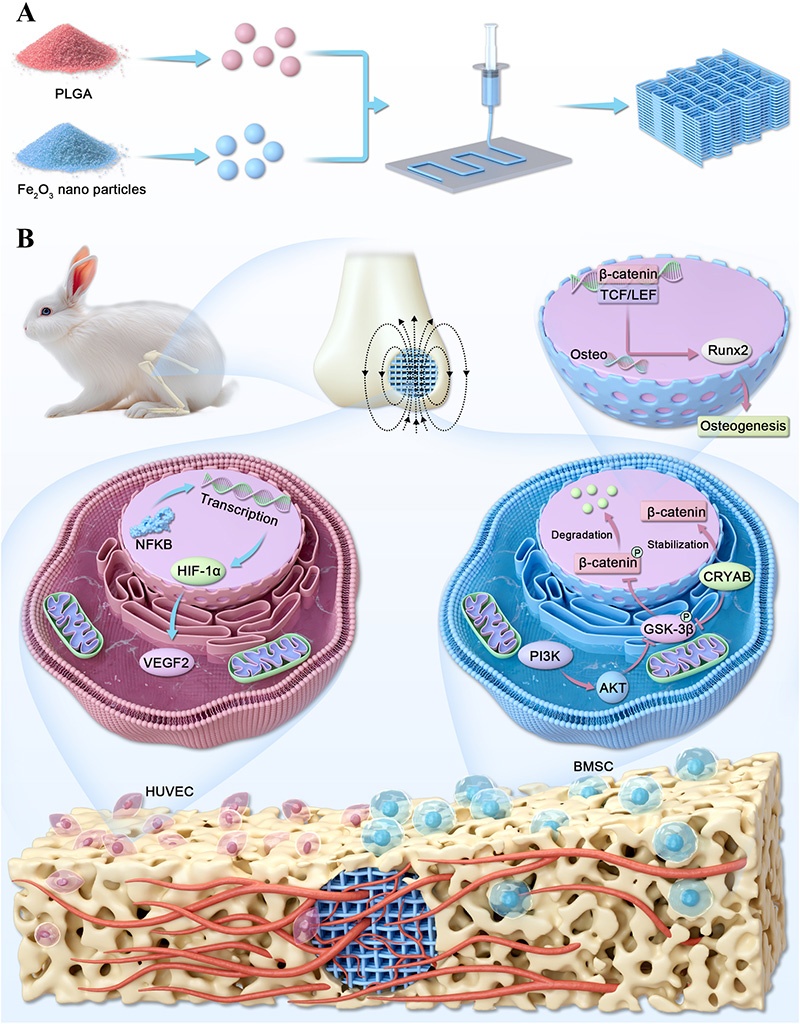
图7. 支架制备及静态磁场刺激下PLGA/Fe₂O₃支架诱导成骨和血管生成的机制示意图。A:3D打印磁性支架的制备过程;B:在静态磁场刺激下,植入的PLGA/Fe₂O₃支架在骨缺损区域同时增强血管生成和成骨的分子机制
所有实验每组至少重复三次,使用GraphPad Prism 7软件进行统计分析。定量数据以均值±标准差(SD)表示,两组间比较采用Student's t检验,多组间比较采用双因素方差分析(two-way ANOVA)结合Tukey事后检验,p<0.05被认为具有统计学意义。
1. 成功制备了负载Fe₂O₃纳米颗粒的3D打印PLGA复合支架(PLGA、P10F、P20F、P30F),该支架具有分级多孔结构,Fe₂O₃颗粒尺寸均匀(平均约27.8nm),分散良好。随着Fe₂O₃含量增加,支架表面亲水性增强(P20F为亲水性),压缩模量和强度提高,且具有良好的超顺磁性和降解性能,在降解过程中Fe³⁺缓慢释放。
2. 体外实验表明,PLGA/Fe₂O₃支架具有优异的生物相容性,能够支持hBMSCs和HUVECs的附着、存活和增殖。在静态磁场作用下,该支架显著促进HUVECs的迁移和管形成能力,上调血管生成相关蛋白VEGFR2和HIF-1α的表达;同时,增强hBMSCs的ALP活性和钙沉积,上调成骨相关转录因子Runx2的表达,其中P20F支架表现出最优的成骨和血管生成促进效果,且IONPs本身而非单纯的Fe³⁺释放是发挥作用的关键。
3. 体内实验中,在兔子股骨髁骨缺损模型中,P20F支架在静态磁场刺激下,显著促进新骨形成和血管再生,micro-CT分析显示其BV/TV、Tb.N、BMD显著高于对照组和PLGA组,Tb.Sp显著降低,血管体积也明显增加;组织学分析进一步证实P20F组OCN、CD31和VEGFA的表达水平最高。
4. 蛋白质组学和生物信息学分析揭示,PLGA/Fe₂O₃支架在静态磁场下,通过上调hBMSCs中CRYAB的表达,激活PI3K-AKT信号通路,CRYAB与β-连环蛋白结合并稳定其表达,进而促进成骨分化;在HUVECs中,激活NF-κB/HIF-1α信号通路,上调VEGF表达,促进血管生成。
5. 本研究首次证实CRYAB介导的β-连环蛋白稳定在磁性支架诱导的骨再生中起核心作用,为功能性骨替代物的设计提供了新的见解,同时也为骨缺损的治疗提供了一种有潜力的策略。
| 项目 | 详情 |
|---|---|
| 论文标题 | 3D-printed magnetic scaffolds promote bone and vessel regeneration through CRYAB/PI3K-AKT and NF-κB pathways identified by proteomics |
| 发表期刊 | Bioactive Materials |
| 发表年份 | 2026年 |
| 卷期页码 | 56(2026)277-293 |
| DOI | https://doi.org/10.1016/j.bioactmat.2025.10.013 |
| 作者 | Jieying Liu、Fuze Liu、Cairong Li、Zhengyao Li、Tianle Li、Yuanhao Wu、Di Wu、Yue Huang、Hui Chen、Hai Wang*、Yuxiao Lai**、Zhihong Wu***等 |
| 作者单位 | 北京协和医学院医院骨科、中国科学院深圳先进技术研究院转化医学研发中心、国家转化医学基础设施(北京协和医院)生物标志物发现与验证中心、中国医学科学院整形外科医院、香港大学牙医学院、上海交通大学医学院附属第六人民医院骨科、北京协和医学院医院复杂疑难罕见病国家重点实验室等 |
| 关键词 | 3D打印、磁性支架、成骨作用、血管生成、蛋白质组学 |
|
|
全面解析森工DIW墨水直写3D打印机在该类研究中功能匹配情况及需定制功能,帮助用户更好地选择合适的3D打印设备及功能模块。
①高温平台:支持室温-100℃有效辅助温敏水凝胶材料打印后辅助固化成型;
①可搭载紫外灯辅助固化成型模块该模块支持多种波长范围,有效辅助含光引发剂直写材料的辅助固化成型;
③可搭载低温直写喷头/平台模块该模块支持-5℃-室温,能快速提高固化效率,保障材料打印成型效果;
①支持4波长紫外固化灯(365、385、395、405nm),实现距离、照射角度、光功率等多参数可调;
②同轴双料筒满载10CC可独立调压,实现不同材料管状等复杂结构打印;
③低温直写喷头/平台模块:支持-5℃~室温,喷头料筒满载容量10cc,独立分布式控温,打印材料在料筒及针尖均可实现精确温控;低温平台实现模块化冷井设计,支持对玻片、孔板(6、12、24、48、96孔)直接使用,有效制冷区域尺寸:90mm*90mm*75mm;控温范围:-5℃-室温
由于小编学识所限,文中内容难免存在疏漏或不足之处。若您发现任何错误或值得商榷的观点,恳请不吝指正,
小编将第一时间修正完善。感谢您的包容与支持!
本文内容来源于网络公开素材,发布的目的在于学术交流、研讨分享,
如相关内容涉及侵权,请联系我们,将第一时间下架内容!

生物3D打印的技术类型有哪些,各有什么优势?

DIW直写3D打印:凭啥成为科研圈“顶流”?材料自由+微构能力双buff拉满

3D打印高性能Ag/BaTiO₃陶瓷-聚合物压电传感器,赋能生物医学应用
用于3D打印分层多孔电极的Co₃O₄/CeO₂高性能墨水,助力固态超级电容器能量密度跃升
基于直写式垂直 3D 打印技术、嵌入多个人工机械感受器的防水纤毛电子皮肤及其在船员健康管理中的应用

再传喜报,森工AutoBio1000直写3D打印设备助力华师大&韩国KAIST科研团队在材料科学顶刊发表高水平论文